Το μόριο είναι μια σταθερή ομάδα δύο ή περισσοτέρων ατόμων, το ίδιο ή διαφορετικό, ενωμένο μέσω ομοιοπολικών δεσμών.
Οι μοριακές ενώσεις ταξινομούνται σύμφωνα με την πολικότητα.
- Αποπολικά μόρια: δεν υπάρχει διαφορά στην ηλεκτροπαραγωγικότητα μεταξύ ατόμων.
- Πολικά μόρια: υπάρχει διαφορά στην ηλεκτροπαραγωγικότητα μεταξύ των ατόμων, με θετικό πόλο και αρνητικό πόλο.
Όταν το μόριο σχηματίζεται από περισσότερα από ένα χημικά στοιχεία, ο αριθμός των ηλεκτρονικών σύννεφων και προσδεμάτων στο κεντρικό άτομο καθορίζει την πολικότητα.
μη πολικά μόρια
Τα μόρια έχουν τα άτομα τους ενωμένα με ομοιοπολικούς δεσμούς, δηλαδή, τα ηλεκτρόνια μοιράζονται.
ηλεκτροαρνητικότητα Είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε ένα δεσμό, σχηματίζοντας πόλους στο μόριο.
Το άτομο που προσελκύει τα ηλεκτρόνια γίνεται ο αρνητικός πόλος, με τη συσσώρευση αρνητικού φορτίου και το άλλο άτομο γίνεται ο θετικός πόλος.
Όταν ένα μόριο σχηματίζεται από άτομα ενός μεμονωμένου χημικού στοιχείου, δεν υπάρχει διαφορά στην ηλεκτροαρνητικότητα και το μόριο είναι απολύω.

Τα μόρια απλών ουσιών όπως το Ο2 και όχι2, σχηματίζονται από άτομα του ίδιου στοιχείου · τα μόρια των σύνθετων ουσιών, από την άλλη πλευρά, έχουν τουλάχιστον δύο διαφορετικά στοιχεία.

Στο μόρια CO2 και BeH2 Είναι επίσης μη πολικοί λόγω γεωμετρίας. Δεδομένου ότι και οι δύο έχουν γραμμική γεωμετρία, τα άτομα στα άκρα, οξυγόνο και υδρογόνο, προσελκύουν τα ηλεκτρόνια του δεσμού το ένα προς το άλλο, καθώς είναι πιο ηλεκτροαρνητικά.
Η έλξη του ατόμου στα αριστερά αντισταθμίζεται από την έλξη του ατόμου στα δεξιά. Καθώς οι δεσμοί είναι ίδιοι, δηλαδή έχουν την ίδια ένταση αλλά διαφορετικές κατευθύνσεις, τα μόρια δεν σχηματίζουν πόλους.
πολικά μόρια
Όταν ένα μόριο σχηματίζεται από διαφορετικά άτομα, υπάρχει μια διαφορά στην ηλεκτροπαραγωγικότητα, αλλά είναι το γεωμετρία μορίων που καθορίζει εάν θα είναι πολικό ή μη πολικό.
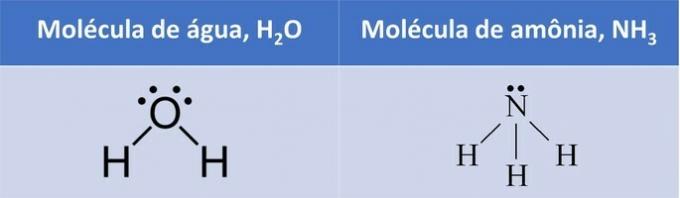
Και στα δύο παραδείγματα, βλέπουμε ότι τα κεντρικά άτομα, το οξυγόνο και το άζωτο, έχουν ζεύγη ηλεκτρονίων που σχηματίζουν σύννεφα ηλεκτρονίων.
Δεδομένου ότι υπάρχουν περισσότερα σύννεφα ηλεκτρονίων γύρω από το κεντρικό άτομο από ότι υπάρχουν ισοδύναμα άτομα που συνδέονται με αυτό, το μόριο είναι πολικός.
Με το σχηματισμό ενός ηλεκτρονικού σύννεφου, το μόριο αναλαμβάνει μια δομή που φιλοξενεί καλύτερα τα άτομα και, επομένως, η γεωμετρία του νερού είναι γωνιακή και πυραμιδική αμμωνία.
Θέλετε να εμπλουτίσετε τις γνώσεις σας; Μην χάσετε τα παρακάτω κείμενα!
- Βιομόρια
- διαμοριακές δυνάμεις
- μοριακός τύπος
- Μοριακή μάζα
Άσκηση με σχόλια
1. Υποδείξτε την πολικότητα των μορίων:
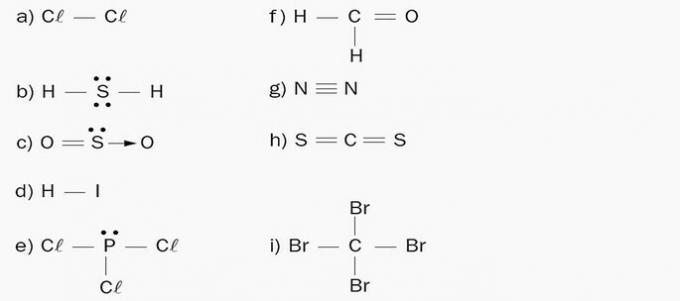
α) Απόλλων. Το μόριο αποτελείται από ένα μόνο χημικό στοιχείο, το χλώριο. Δεδομένου ότι δεν υπάρχει διαφορά στην ηλεκτροαρνητικότητα, δεν σχηματίζονται πόλοι.
β) Πολικό. Υπάρχουν 4 σύννεφα ηλεκτρονίων και 2 ίσα άτομα (H) συνδεδεμένα στο κεντρικό στοιχείο (S).
γ) Πολικό. Υπάρχουν 3 ηλεκτρονικά σύννεφα και 2 ίσα άτομα (O) συνδεδεμένα στο κεντρικό στοιχείο (S).
δ) Πολικό. Τα στοιχεία του μορίου έχουν διαφορετικές ηλεκτρονενητότητες. Ένας αρνητικός πόλος σχηματίζεται στο ιώδιο λόγω της συσσώρευσης αρνητικού φορτίου, και κατά συνέπεια η πλευρά του υδρογόνου σχηματίζει έναν θετικό πόλο.
ε) Πολικό. Υπάρχουν 4 σύννεφα ηλεκτρονίων και 3 ίσα άτομα (Cl) συνδεδεμένα στο κεντρικό στοιχείο (P).
στ) Πολικό. Υπάρχει μια ασύμμετρη κατανομή φορτίων στο μόριο, καθώς ο άνθρακας έχει διαφορετικά προσδέματα.
ζ) Απόλλωνα. Το μόριο είναι διατομικό και αποτελείται από άτομα του ίδιου χημικού στοιχείου, οπότε δεν υπάρχει διαφορά στην ηλεκτρονανητικότητα.
η) Απόλλωνα. Ο αριθμός των νεφών ηλεκτρονίων είναι ίσος με τον αριθμό των ατόμων που συνδέονται με το κεντρικό άτομο.
i) Απόλλωνα. Ο αριθμός των νεφών ηλεκτρονίων είναι ίσος με τον αριθμό των ατόμων που συνδέονται με το κεντρικό άτομο.
2. (Fuvest) Εξετάστε τα μόρια των HF, HCl, H2Ο, Χ2Ο2 και CH4.
α) Ταξινομήστε αυτά τα μόρια σε δύο ομάδες: πολικά και μη πολικά.
| Πολικός | απολόος |
|---|---|
| Υδροφθόριο (HF) | Μοριακό υδρογόνο (Η2) |
| Υδροχλωρίδιο (HCl) | Μοριακό Οξυγόνο (Ο2) |
| Νερό (Η2Ο) | Μεθάνιο (CH4) |
HF, HCl και Η2Είναι πολικά επειδή στις τρεις ενώσεις το υδρογόνο συνδέεται με πολύ ηλεκτροαρνητικά στοιχεία.
Η2 είναι το2 είναι μη πολικές, καθώς δεν υπάρχει διαφορά στην ηλεκτροαναρτητικότητα στα μόρια. το CH4 Είναι επίσης μη πολικό επειδή ο αριθμός των νεφών ηλεκτρονίων είναι ίσος με τον αριθμό των στοιχείων που συνδέονται με το κεντρικό άτομο, τον άνθρακα.
Ιδιότητα που αναφέρεται στο άτομο: ηλεκτροαρνητικότητα.
Τα μόρια που αποτελούνται από άτομα ενός μόνο χημικού στοιχείου έχουν ταξινομηθεί ως μη πολικά, καθώς δεν υπάρχει διαφορά στην ηλεκτροπαραγωγικότητα.
Ιδιότητα που σχετίζεται με το μόριο: ποσότητα νεφών και αριθμός ίσων προσδεμάτων.
Τα μόρια που σχηματίζονται από άτομα διαφορετικών χημικών στοιχείων ταξινομήθηκαν ως πολικά ή μη πολικά σύμφωνα με τον αριθμό των ηλεκτρονικών σύννεφων και την ποσότητα των προσδεμάτων στο κεντρικό άτομο.
Το νερό είναι πολικό επειδή το κεντρικό άτομο, το οξυγόνο, έχει ένα ζεύγος ηλεκτρονίων, προκαλώντας 3 σύννεφα ηλεκτρονίων και 2 προσδέματα. Επομένως, η κατανομή των φορτίων είναι ασύμμετρη, σχηματίζοντας πόλους στο μόριο.
Το μεθάνιο είναι μη πολικό, καθώς το κεντρικό άτομο, ο άνθρακας, έχει τον αριθμό των προσδεμάτων ίσο με τον αριθμό των ηλεκτρονικών σύννεφων, καθιστώντας τη γεωμετρία τετραεδρικό και δεν υπάρχει πολικότητα στο μόριο.
3. (Vunesp) Μεταξύ των εναλλακτικών παρακάτω, υποδείξτε αυτήν με τη λανθασμένη δήλωση:
α) Ο ομοιοπολικός δεσμός είναι ένας που συμβαίνει μέσω της κατανομής των ηλεκτρονίων μεταξύ δύο ατόμων.
β) Η ομοιοπολική ένωση HCl είναι πολική, λόγω της διαφοράς στην ηλεκτροαναρτητικότητα που υπάρχει μεταξύ των ατόμων υδρογόνου και χλωρίου.
γ) Η ένωση που σχηματίζεται μεταξύ αλκαλικού μετάλλου και αλογόνου είναι ομοιοπολική.
δ) Η ουσία του τύπου Br2 είναι μη πολικό.
ε) Η ουσία του τύπου Cal2 είναι ιοντικό.
Λανθασμένη εναλλακτική λύση: γ) Η ένωση που σχηματίζεται μεταξύ αλκαλικού μετάλλου και αλογόνου είναι ομοιοπολική.
α) ΣΩΣΤΗ. Αυτός ο τύπος δεσμού αντιστοιχεί στην κατανομή ηλεκτρονίων γενικά μεταξύ μη μετάλλων.
β) ΣΩΣΤΗ. Το χλώριο έχει μεγαλύτερη ηλεκτροπαραγωγικότητα από το υδρογόνο και, συνεπώς, προσελκύει το ζεύγος ηλεκτρονίων από τον δεσμό στον εαυτό του, προκαλώντας μια ανισορροπία φορτίου.
Το μόριο HCl είναι πολικό επειδή σχηματίζεται αρνητικός πόλος σε χλώριο λόγω της συσσώρευσης αρνητικού φορτίου και, Κατά συνέπεια, η πλευρά του υδρογόνου τείνει να έχει συσσωρευμένο θετικό φορτίο, σχηματίζοντας έναν πόλο θετικός.
γ) ΑΡΘΡΩΣ. Μέσω ιοντικών δεσμών, τα μέταλλα είναι σε θέση να δωρίσουν ηλεκτρόνια και να παραμείνουν θετικά φορτισμένα, σχηματίζοντας κατιόντα. τα αλογόνα, από την άλλη πλευρά, δέχονται ηλεκτρόνια και σχηματίζουν ανιόντα, είδη με αρνητικό φορτίο.
δ) ΣΩΣΤΗ. Το μόριο είναι διατομικό και αποτελείται από άτομα του ίδιου χημικού στοιχείου, οπότε δεν υπάρχει διαφορά στην ηλεκτρονανητικότητα.
ε) ΣΩΣΤΗ. Στην ιοντική σύνδεση, τα ηλεκτρόνια δωρίζονται ή λαμβάνονται από άτομα. Στην ιοντική ένωση, το ασβέστιο δίνει δύο ηλεκτρόνια και σχηματίζει το κατιόν Ca2+. Το ιώδιο λαμβάνει ηλεκτρόνια από ασβέστιο και σχηματίζει ένα αρνητικά φορτισμένο είδος, I2-.
Φροντίστε να ελέγξετε αυτά τα κείμενα σχετικά με θέματα που σχετίζονται με το θέμα αυτού του περιεχομένου:
- ιοντικοί δεσμοί
- ομοιοπολικούς δεσμούς
- Πολικότητα συνδέσεων
- Απλές και σύνθετες ουσίες
- Γενικές ιδιότητες της ύλης

