Η υδρογόνωση συμβαίνει με ακόρεστους ακυκλικούς υδρογονάνθρακες, δηλαδή, οι οποίες έχουν ανοιχτές αλυσίδες με διπλούς ή τριπλούς δεσμούς, όπως αλκένια, αλκύνια και διένια. Μπορεί επίσης να εμφανιστεί σε αρωματικούς υδρογονάνθρακες, καθώς έχουν διπλούς δεσμούς στον δακτύλιο, και με κυκλάνες (κυκλοαλκάνια) έως και πέντε άνθρακες.
Αυτές οι ενώσεις αντιδρούν σαν αέριο υδρογόνο παρουσία κάποιου καταλύτη, όπως νικέλιο, λευκόχρυσο και παλλάδιο, υπό θέρμανση. Έτσι, λαμβάνει χώρα μια αντίδραση προσθήκης, στην οποία ο δεσμός π (π) σπάει, σχηματίζοντας δύο νέους απλούς δεσμούς και εισάγεται υδρογόνο στο μόριο.
Γενικά, έχουμε:
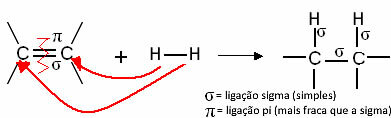
Γενική αντίδραση υδρογόνωσης
Τώρα ας δούμε μερικά παραδείγματα:
- Υδρογόνωση σε αλκένια: Το προϊόν που λαμβάνεται είναι αλκάνιο.
Παρακάτω έχουμε μια αντίδραση υδρογόνωσης αιθυλενίου (ή αιθυλενίου) για τη λήψη αιθανίου:
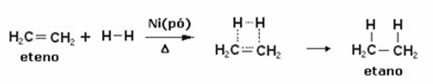
Παράδειγμα αντίδρασης υδρογόνωσης αιθυλενίου
Αυτός ο τύπος καταλυτικής υδρογόνωσης χρησιμοποιείται από τη βιομηχανία τροφίμων για την παραγωγή ημι-στερεών λιπών όπως μαργαρίνες.
Τα φυτικά έλαια και λίπη διαφέρουν μόνο στο ότι τα έλαια έχουν μακρά μόρια με διπλούς δεσμούς μεταξύ άνθρακα, ενώ τα λίπη έχουν μόνο μεμονωμένους δεσμούς μεταξύ τους άνθρακες.Έτσι, για να μετατρέψετε ένα λάδι σε λίπος, αρκεί να υδρογονώσετε το λάδι. Με αυτόν τον τρόπο, οι διπλοί δεσμοί σας θα σπάσουν και θα μετατραπούν σε μονές ομολογίες. Το αποτέλεσμα είναι η παραγωγή κλήσεων υδρογονωμένα φυτικά λίπη.
- Υδρογόνωση αλκινών: Δεδομένου ότι τα αλκύνια έχουν δύο δεσμούς pi, η πλήρης υδρογόνωσή τους πραγματοποιείται σε δύο στάδια, στο πρώτο σχηματίζεται ένα αλκένιο και στο δεύτερο, ένα αλκάνιο.
Στην αντίδραση παρακάτω, έχουμε την υδρογόνωση της προπίνης με τελικό σχηματισμό προπανίου:
1ο βήμα: Η3Γ Γ ≡ CH + Η2 → Η3Γ ΓΗ═ ΝΤΟΗ2
2ο στάδιο: Η3Γ ΓΗ═ ΝΤΟΗ2 + 2 ώρες2 → Η3Γ ΓΗ2─ ΝΤΟΗ3
Αν θέλουμε να σταματήσει αυτή η αντίδραση στο 1ο βήμα, πρέπει να χρησιμοποιήσουμε κάποια ουσία που διακόπτει τη δράση του καταλύτη.
- Υδρογόνωση των διενίων: Υπάρχουν τρεις τύποι διένων: συσσωρευμένος (διπλοί δεσμοί εμφανίζονται παρακάτω), απομονωμένος (οι διπλοί δεσμοί διαχωρίζονται από τουλάχιστον δύο μεμονωμένους δεσμούς) και συζυγή (διπλοί δεσμοί εμφανίζονται εναλλάξ).
Η υδρογόνωση των συσσωρευμένων και απομονωμένων διένων συμβαίνει με τον ίδιο τρόπο που είδαμε για τα αλκένια, αλλά σε διπλά, καθώς τα διένια έχουν περισσότερο ακόρεστο. Δείτε δύο παραδείγματα:
* Παράδειγμα υδρογόνωσης σε συσσωρευμένο διένιο:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Χ Η Χ
│ │ │
Η3Γ CH ═ ΝΤΟ ═ Χ.Χ. Χ.Χ.3 + 2 ώρες2 → Η3Γ CH ─ ΝΤΟ ─ Χ.Χ. Χ.Χ.3
│ │ │
Χ Η Χ
* Παράδειγμα υδρογόνωσης σε απομονωμένο διένιο:
Χ Η Χ Χ
│ │ │ │
Η3Γ CH ═ CH─CH2 Χ.Χ. ═ Χ.Χ. Χ.Χ.3 +2 Ω2 → Η3Γ CH ─ CH─CH2 Χ.Χ. ─ Χ.Χ. Χ.Χ.3
Από την άλλη πλευρά, η υδρογόνωση των συζευγμένων διένων μπορεί να συμβεί με δύο τρόπους: με 1,2 προσθήκη και 1,4 προσθήκη. Η πιο συνηθισμένη είναι η προσθήκη 1,2, στην οποία προστίθενται υδρογόνα σε άνθρακες που δημιουργούν το διπλό δεσμό και σε χαμηλές θερμοκρασίες. Η προσθήκη 1,4, από την άλλη πλευρά, εμφανίζεται σε υψηλές θερμοκρασίες και είναι όταν υπάρχει συντονισμός και εμφάνιση ελεύθερων σθένους στους άνθρακες 1 και 4. Δείτε παραδείγματα κάθε περίπτωσης:
* Παράδειγμα 1.2 προσθήκης σε συζευγμένα διένια:
Η2Γ CH ─ CH ═ CH2 + Η2 → Η2C CH ─ C ─ CH Χ.Χ.2
│ │
Χ Χ
* Παράδειγμα προσθήκης 1.4 σε συζευγμένα διένια:
Η2Γ CH ─ CH ═ CH2 + Η2 → Η2Γ CH ═ Χ.Χ. Χ.Χ.2
│ │
Χ Χ
- Υδρογόνωση αρωματικών: Οι δεσμοί pi του δακτυλίου βενζολίου είναι σπασμένοι και τα άτομα υδρογόνου προστίθενται στους άνθρακες που δημιουργούν αυτούς τους δεσμούς.
Αυτός ο τύπος ολικής υδρογόνωσης φαίνεται παρακάτω:

Ολική αντίδραση υδρογόνωσης βενζολίου
- Υδρογόνωση κυκλάνης: Εμφανίζεται σχηματισμός αλκανίου.
Παράδειγμα: Υδρογόνωση του κυκλοπροπανίου:
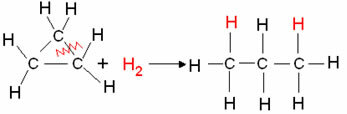
Αντίδραση υδρογόνωσης κυκλοπροπανίου
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αντίδραση οργανικής υδρογόνωσης" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Περιέργειες

Πώς προέκυψε η μαργαρίνη;, μαργαρίνη, ιστορία της εμφάνισης της μαργαρίνης, βραβείο που κέρδισε ο Hippólyte de Mége Mouriés το έτος 1869, βραβείο που πρότεινε η κυβέρνηση του Ναπολέοντα, σε μια εποχή που η Γαλλία αντιμετώπιζε μια σοβαρή οικονομική κρίση, πολλά ανοίγματα