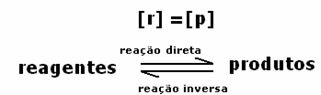
Δυναμική ισορροπία ή χημική ισορροπία μιας αντίδρασης συμβαίνει όταν οι εμπρός και αντίστροφες αντιδράσεις εμφανίζονται ταυτόχρονα. Αυτά τα αποκαλούμενα αναστρέψιμα συστήματα αντιπροσωπεύονται από βέλη και προς τις δύο κατευθύνσεις:  ή
ή  . Ένα παράδειγμα αναστρέψιμης αντίδρασης αναφέρεται στην παραπάνω εικόνα, μεταξύ αερίου ιωδίου και αερίου υδρογόνου.
. Ένα παράδειγμα αναστρέψιμης αντίδρασης αναφέρεται στην παραπάνω εικόνα, μεταξύ αερίου ιωδίου και αερίου υδρογόνου.
Κατά την έναρξη της αντίδρασης, η ποσότητα των αντιδρώντων είναι μέγιστη και αυτή των προϊόντων είναι μηδέν. Ωστόσο, τα αντιδραστήρια αντιδρούν μεταξύ τους, μειώνοντας τη συγκέντρωσή τους και αυξάνοντας αυτά των σχηματισμένων προϊόντων. Ο ρυθμός ανάπτυξης της άμεσης αντίδρασης μειώνεται επίσης.
Καθώς η συγκέντρωση των προϊόντων αυξάνεται, ξεκινά η αντίστροφη αντίδραση και τα αντιδραστήρια σχηματίζονται ξανά. αυξάνεται επίσης ο ρυθμός ανάπτυξης της αντίστροφης αντίδρασης.
Με την επίτευξη χημικής ισορροπίας σε σταθερή θερμοκρασία, οι ρυθμοί ανάπτυξης των εμπρός και αντίστροφων αντιδράσεων είναι ίσοι.
Ολααπευθείας = Όλα αντίστροφος
Οι τιμές είναι οι ίδιες, αλλά οι συγκεντρώσεις δεν είναι. Οι συγκεντρώσεις αντιδραστηρίων και προϊόντων είναι απίθανο να είναι ίδιες. Αυτό συμβαίνει μόνο σε σπάνιες περιπτώσεις. Στις περισσότερες περιπτώσεις, η συγκέντρωση των αντιδραστηρίων θα είναι υψηλότερη από εκείνη των προϊόντων ή αντίστροφα.
Έτσι, έχουμε τρεις πιθανούς τρόπους για να απεικονίσουμε γραφικά τους ρυθμούς ανάπτυξης του άμεσες και αντίστροφες αντιδράσεις, που σχετίζονται με τις συγκεντρώσεις των αντιδραστηρίων και των προϊόντων πάνω από το χρόνος. Ας δούμε κάθε περίπτωση:
1η περίπτωση: Ίσες συγκεντρώσεις:
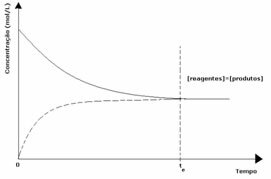
Όπως φαίνεται στο γράφημα, τη στιγμή tκαι οι εμπρόσθιες και αντίστροφες αντιδράσεις είναι οι ίδιες, οπότε οι συγκεντρώσεις των αντιδραστηρίων και των προϊόντων είναι ίδιες. Έτσι, η ισορροπία δεν μετατοπίζεται σε καμία πλευρά, η ένταση και των δύο αντιδράσεων είναι η ίδια, όπως εκφράζεται παρακάτω:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
2η περίπτωση: Συγκέντρωση αντιδραστηρίων μεγαλύτερη από τη συγκέντρωση προϊόντων:
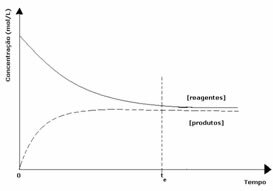
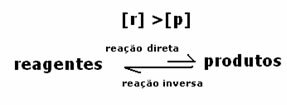
Σε αυτήν την περίπτωση, παρατηρείται ότι όταν επιτυγχάνεται ισορροπία, η συγκέντρωση των αντιδραστηρίων είναι μεγαλύτερη από εκείνη των προϊόντων. Έτσι, συνάγεται το συμπέρασμα ότι εάν υπάρχει περισσότερο αντιδρών, η αντίστροφη αντίδραση λαμβάνει χώρα με μεγαλύτερη ένταση. Η αντίδραση μετατοπίζεται προς τα αριστερά:
3η περίπτωση: Συγκέντρωση προϊόντων μεγαλύτερη από εκείνη των αντιδραστηρίων:
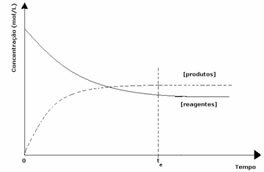
Δεδομένου ότι σε ισορροπία η συγκέντρωση των προϊόντων είναι μεγαλύτερη, αυτό σημαίνει ότι η αντίδραση είναι μετατοπίζεται προς τα δεξιά, επειδή η άμεση αντίδραση (με σχηματισμό προϊόντων) εμφανίζεται με μεγαλύτερη ένταση.
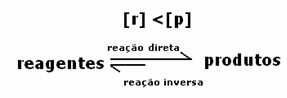
Αυτό που θα δείξει εάν η αντίδραση τείνει προς τα δεξιά ή προς τα αριστερά θα είναι η σταθερά ισορροπίας Κ, η οποία εξαρτάται μόνο από τη θερμοκρασία.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Γραφική μελέτη χημικής ισορροπίας" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Χημεία

Δοκιμάστε τις γνώσεις σας και μάθετε περισσότερα με αυτόν τον κατάλογο λύσεων για χημικές ισορροπίες. Μέσω αυτού του υλικού, θα είστε σε θέση να κατανοήσετε καλύτερα πώς να εργάζεστε σταθερές ισορροπίας (Kp, Kc και Ki), μετατόπιση ισορροπίας, pH και pOH, καθώς και ισορροπία σε λεγόμενες ρυθμιστικές λύσεις.


