Ο νόμος του Έσση δημιουργήθηκε από τον Ελβετό χημικό Germain H. Hess (1802-1850), ο οποίος θεωρείται ένας από τους ιδρυτές της Θερμοχημείας. Ο νόμος του είπε:

Δηλαδή, το ΔΗ εξαρτάται μόνο από τις τιμές ενθαλπίας των αντιδραστηρίων και των προϊόντων, όπως στην έκφραση:
| ΔΗ = ΔΗαντιδραστήρια + ΔΗπροϊόντα |
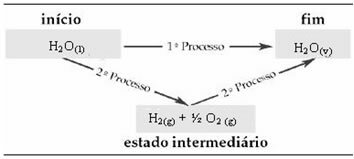
Για παράδειγμα, εξετάστε την αντίδραση όπου 1 mol νερού (Η2Ο) μετατρέπεται σε νερό σε αέρια κατάσταση. Αυτή η αντίδραση εκτελείται δύο φορές. Ωστόσο, επιλέχθηκαν διαφορετικές διαδρομές:
(1ο) Πραγματοποιήθηκε σε ένα μόνο βήμα:
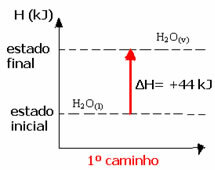
Η2Ο(1) → Η2Ο(v) ΔΗ = +44 kJ
(2ο) Διεξήχθη σε δύο στάδια:
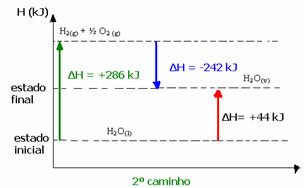
1ο βήμα: Η2Ο(1) → Η2 (ζ) + ½ το2 (ζ) ΔΗ = +286 kJ
2ο στάδιο: Η2 (ζ) + ½ το2 (ζ) → Η2Ο(v) ΔΗ = -242 kJ
Η2Ο(1) → Η2Ο(v) ΔΗ = +44 kJ
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Σημειώστε ότι ανεξάρτητα από το εάν έχουν πραγματοποιηθεί ένα ή δύο βήματα, η αλλαγή της ενθαλπίας (ΔΗ) είναι πάντα 44 kJ. Αυτό συμβαίνει επειδή το ΔΗ είναι το αλγεβρικό άθροισμα των τιμών valoresH των βημάτων που συνθέτουν τη διαδικασία, δηλαδή των ενδιάμεσων διεργασιών:
| ΔΗ = ΔΗ1 + ΔΗ2 + ΔΗ3 + ... |
Για παράδειγμα, στη δεύτερη περίπτωση, το συνολικό ΔΗ της αντίδρασης ήταν το άθροισμα του ΔΗ του πρώτου σταδίου (ΔΗ = +286 kJ) με αυτό του δεύτερου (ΔΗ = -242 kJ). Έτσι, αποκτήσαμε την ίδια τιμή αντίδρασης με ένα μόνο βήμα:
ΔΗ = (+286 + (-242)) kJ
ΔΗ = (+286-224) kJ
ΔΗ = +44 kJ
Επομένως, ενδιαφερόμαστε μόνο για τις αρχικές και τελικές τιμές. Σε αυτήν την περίπτωση, η αρχική κατάσταση αντιστοιχεί στο Η2Ο(1) και το τέλος στο Η2Ο(v).
Αυτός ο νόμος έχει γίνει πολύ σημαντικός στη Θερμοχημεία, επειδή ορισμένες χημικές αντιδράσεις δεν μπορούν να προσδιορίσουν πειραματικά τη ΔΗ τους. Ωστόσο, σύμφωνα με τον νόμο του Έσση, η ενθαλπία αυτού του τύπου αντίδρασης μπορεί να υπολογιστεί από τις ενθαλπίες άλλων αντιδράσεων (ενδιάμεσες αντιδράσεις).
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. «Ο νόμος του Έσση». Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Πρόσβαση στις 28 Ιουνίου 2021.