το χημικό στοιχείο φωσφόρος (Ρ) ανήκει στην τρίτη περίοδο του περιοδικού πίνακα και στην οικογένεια αζώτου (VA). Για αυτόν τον λόγο, τα άτομα του συνήθως κάνουν τρία χημικοί δεσμοί για να φτάσετε στο θεωρία οκτάδων (σταθερότητα). Ωστόσο, υπάρχουν ορισμένες καταστάσεις στις οποίες ένα άτομο φωσφόρου δημιουργεί περισσότερους από τρεις δεσμούς, γεγονός που είναι δυνατό μόνο μέσω του φαινόμενο υβριδισμού.
Για να καταλάβετε το υβριδισμός φωσφόρου, πρέπει πρώτα να καταλάβουμε γιατί το άτομο αυτού του στοιχείου δημιουργεί τρεις δεσμούς. Για να το κάνουμε αυτό, απλώς πρέπει να παρακολουθούμε την ηλεκτρονική σας διανομή:

Ηλεκτρονική διανομή φωσφόρου
Μπορούμε να παρατηρήσουμε ότι, στο στρώμα σθένους, το άτομο φωσφόρου έχει το πλήρες υπόστρωμα 3s (με δύο ηλεκτρόνια) και το ημιτελές υπόστρωμα 3p (καθένα από τα τρία τροχιακά υποβρύχια έχει α ηλεκτρόνιο). Παρακάτω έχουμε την κατανομή των ηλεκτρονίων στις τροχιές των επιπέδων του Στρώμα σθένους φωσφόρου:
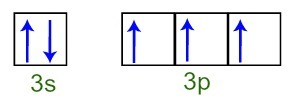
Αναπαράσταση των ηλεκτρονίων του κελύφους σθένους του ατόμου φωσφόρου
Δεδομένου ότι καθένα από τα 3p υπογλώσσια τροχιά είναι ατελές, το άτομο φωσφόρου είναι ικανό να δημιουργήσει τρεις χημικούς δεσμούς, επιτυγχάνοντας έτσι σταθερότητα.
Τώρα όταν εξετάζουμε την ουσία PCl5, για παράδειγμα, είμαστε βέβαιοι ότι, σε αυτό το μόριο, ο φωσφόρος υπέστη υβριδοποίηση, καθώς έκανε πέντε συνδέσεις. Καθώς το χλώριο, το οποίο ανήκει στην οικογένεια VIIA, χρειάζεται έναν δεσμό για να είναι σταθερό και το μόριο έχει πέντε άτομα από αυτό στοιχείο, καθένας από αυτούς πρέπει να κάνει έναν δεσμό, ο οποίος κάνει το άτομο φωσφόρου, με τη σειρά του, πρέπει επίσης να κάνει πέντε Συνδέσεις. Αυτή η εμφάνιση είναι δυνατή μόνο μέσω του υβριδισμός (ένωση ατελών ατομικών τροχιακών) φωσφόρου.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Κατά τη λήψη ενέργειας από το εξωτερικό περιβάλλον, τα ηλεκτρόνια του ατόμου του φωσφόρου γίνονται ενθουσιασμένα. Λίγο αργότερα, ένα από τα δύο ηλεκτρόνια που ανήκουν στο υπόστρωμα 3s μετακινείται σε ένα κενό τροχιακό παρόν στο υπό-επίπεδο, το οποίο μέχρι στιγμής δεν έχει ηλεκτρόνια. Δείτε το παρακάτω διάγραμμα:
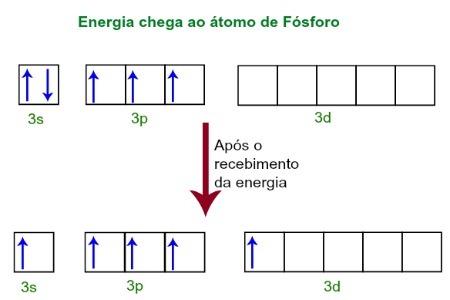
Με τη λήψη ενέργειας, τα ηλεκτρόνια του φωσφόρου διεγείρονται και κάποιος καταλαμβάνει μια τροχιά του d επιπέδου.
Αυτή τη στιγμή, έχουμε στο στρώμα σθένους του Φωσφόρου ένα τροχιακό s, τρία p τροχιακά και ένα ελλιπές d τροχιακό.Τελικά, αυτά τα πέντε τροχιακά υβριδοποιούνται, δηλαδή, ενώνονται, με αποτέλεσμα πέντε ατελή ατομικά τροχιακά, τα οποία είναι πλέον σε θέση να δημιουργήσουν πέντε χημικούς δεσμούς.

Υβριδισμός ατελών ατομικών τροχιών φωσφόρου
Καθώς ένα τροχιακό s, τρία p τροχιακά και ένα d orbital ενώθηκαν, ο υβριδισμός του φωσφόρου είναι του τύπου sp3ρε.
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Υβριδισμός φωσφόρου" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Πρόσβαση στις 28 Ιουνίου 2021.