Η πολικότητα των μορίων είναι μια πολύ σημαντική άποψη, καθώς τα χαρακτηριστικά των ουσιών καθορίζονται, μεταξύ άλλων παραγόντων, από το γεγονός ότι τα μόρια τους είναι πολικά ή μη-πολικά.
Ο προσδιορισμός της πολικότητας ενός μορίου μπορεί να πραγματοποιηθεί χρησιμοποιώντας το Διπολη ΣΤΙΓΜΗ ή Αποτέλεσμα της διπολικής στιγμής, το σύμβολο του οποίου είναι 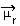 . Αν μιλάμε απλώς για τη διπολική ροπή κάθε δεσμού στο μόριο, τότε το σύμβολο είναι το ελληνικό γράμμα mi (μ).
. Αν μιλάμε απλώς για τη διπολική ροπή κάθε δεσμού στο μόριο, τότε το σύμβολο είναι το ελληνικό γράμμα mi (μ).

Το μόριο θα είναι μη-πολικό εάν η διπολική ροπή είναι ίση με το μηδέν, αλλά αν είναι μη-μηδέν, σημαίνει ότι είναι πολικό.

Υπάρχουν δύο σημαντικά πράγματα που πρέπει να λάβετε υπόψη για τον προσδιορισμό αυτής της διπολικής ροπής που προκύπτει. Ας δούμε τι είναι:
1) διαφορά ηλεκτροαρνητικότητας μεταξύ των ατόμων των στοιχείων που συμμετέχουν στην αντίδραση. Για παράδειγμα, το μόριο HF έχει αξιοσημείωτη διαφορά στην ηλεκτροπαραγωγικότητα, καθώς το φθόριο προσελκύει, πολύ περισσότερο από το υδρογόνο, το ζεύγος ηλεκτρονίων στον δεσμό. Έτσι, η κατανομή των φορτίων δεν είναι συμμετρική, με ηλεκτρικά δίπολα.
Αυτό το δίπολο παριστάνεται από έναν φορέα που βλέπει το άκρο που συγκεντρώνει τα περισσότερα ηλεκτρόνια, δηλαδή, από το λιγότερο στο πιο ηλεκτροαρνητικό άτομο. Έτσι, σε αυτήν την περίπτωση, το διάνυσμα, που είναι το μόνο, θα είναι το προκύπτον διάνυσμα, όπως υποδεικνύεται παρακάτω:
Σημειώστε ότι η τιμή του διανύσματος είναι η ίδια με τη διπολική ροπή, η οποία δίνεται στη μονάδα debye (D = 3,33. 10-30 κουλόμβ. μετρό). Δεδομένου ότι η διπολική ροπή είναι μη μηδενική, το μόριο και ο δεσμός είναι πολικός.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
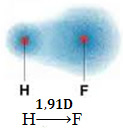
Στο παρακάτω μόριο, έχουμε επίσης ένα μόριο με δύο μόνο άτομα, ωστόσο, στην περίπτωση αυτή, αντιστοιχεί σε μια απλή ουσία, δηλαδή σχηματίζεται από έναν μόνο τύπο στοιχείου. Επομένως, δεν υπάρχει διαφορά ηλεκτροπαραγωγικότητας. Τα άτομα προσελκύουν επίσης ηλεκτρόνια, τα οποία κατανέμονται συμμετρικά. Η προκύπτουσα διπολική ροπή είναι ίση με το μηδέν, οπότε τόσο ο δεσμός όσο και το μόριο είναι απολόος.
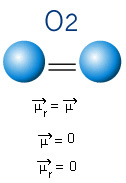
2) Γεωμετρία μορίων, δηλαδή, η χωρική διάταξη των διανυσμάτων. Το μόριο BF3 έχει τρεις πολικούς δεσμούς, στους οποίους το φθόριο είναι το πιο ηλεκτροαρνητικό, έχοντας έτσι τους φορείς να κατευθύνονται προς αυτό. Ωστόσο, δεδομένου ότι η χωρική διάταξη των ατόμων είναι τριγωνική επίπεδη, αυτό κάνει τα ηλεκτρόνια να έχουν συμμετρική κατανομή γύρω από το κεντρικό άτομο. Έτσι, το αποτέλεσμα είναι ότι αυτοί οι τρεις φορείς ακυρώνουν ο ένας τον άλλον και η διπολική ροπή είναι ίση με το μηδέν. Επομένως, το μόριο BF3 é απολύω.
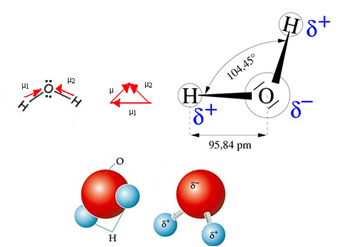
Το μόριο του νερού έχει δύο φορείς, ωστόσο, η χωρική γεωμετρία του δεν είναι επίπεδη, αλλά σε σχήμα V. Σημειώστε στο παρακάτω σχήμα ότι με αυτόν τον τρόπο τα διανύσματα τους δεν αλληλοαναιρούνται, τα ηλεκτρόνια κατανέμονται ασύμμετρα και συγκεντρώνονται περισσότερο στο πιο ηλεκτροαρνητικό άτομο, το οποίο είναι οξυγόνο. Έτσι, η διπολική ροπή είναι διαφορετική από το μηδέν και το μόριο νερού είναι πολικός:
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία

