Ο αυτόματη μείωση ή δυσανάλογη αντίδραση είναι ένας τύπος αντίδρασης οξειδοαναγωγής στον οποίο υφίσταται το ίδιο χημικό στοιχείο οξείδωση και μείωση. Ας δούμε δύο παραδείγματα αυτού του τύπου αντίδρασης και πώς να τα εξισορροπήσουμε χρησιμοποιώντας τη μέθοδο redox:
1ο Παράδειγμα:
ΣΤΟ2- + Χ+ → ΟΧΙ3- + ΟΧΙ + Η2Ο
- Υπολογίζοντας τους αριθμούς οξείδωσης (NOX) όλων των ατόμων και ιόντων που εμπλέκονται στην αντίδραση, είναι δυνατόν να επαληθευτεί ποιος οξειδώθηκε και ποιος αντέδρασε:
+3 -2 +1 +5 -2 +2 -2 +1 -2
ΣΤΟ2- + Χ+ → ΟΧΙ3- + ΟΧΙ + Η2Ο
- Σημειώστε ότι το άζωτο ήταν το είδος που αντέδρασε και οξειδώθηκε:
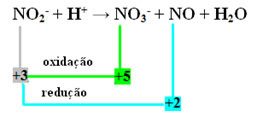
- Για να εξισορροπήσουμε αυτήν την αντίδραση με redox, πρέπει να συσχετίσουμε το NOX με τα προϊόντα και όχι τα αντιδραστήρια:
ΣΤΟ3- = ΔNox = 5 - 3 = 2
ΟΧΙ = ΔNox = 3 - 2 = 1
- Αντιστρέφοντας το ΔNOX από τους συντελεστές, έχουμε:
ΣΤΟ3- = ΔNOX = 2 → 2 θα είναι ο συντελεστής ΝΟ
ΟΧΙ = ΔNOX = 1→ 1 θα είναι ο συντελεστής ΝΟ3-
ΣΤΟ2- + Χ+ → 1 ΣΤΟ3- + 2 ΟΧΙ + Η2Ο
- Με αυτό, γνωρίζουμε ήδη ότι υπάρχουν 3 Ν στο προϊόν, οπότε ο συντελεστής ΝΟ2- θα είναι 3:
3 ΟΧΙ2- + Χ+ → 1 ΟΧΙ3- + 2 ΟΧΙ + Η2Ο
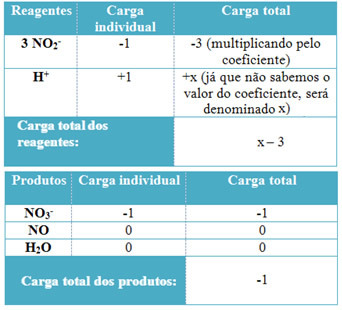
- Για τον προσδιορισμό των συντελεστών του Η+ και από το Η2O, να θυμάστε ότι ο αριθμός των ηλεκτρονίων που λαμβάνονται ισούται με την ίδια ποσότητα ηλεκτρονίων που δόθηκαν. Έτσι, το φορτίο αντιδραστηρίου θα είναι ίσο με το φορτίο προϊόντος. Με αυτόν τον τρόπο, μπορούμε να κάνουμε το ακόλουθο σχήμα:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Με βάση αυτές τις πληροφορίες, έχουμε ότι το συνολικό φορτίο των αντιδραστηρίων είναι ίσο με x - 3 και το προϊόν είναι ίσο με -1. Όπως αναφέρθηκε, οι χρεώσεις των δύο πρέπει να είναι ίσες. Καθώς έχουμε ήδη το συνολικό φορτίο προϊόντων, μπορούμε να κάνουμε έναν απλό υπολογισμό για να γνωρίζουμε ποια θα είναι η τιμή του x:
x -3 = -1
x = -1 +3
x = 2
Έτσι, ο συντελεστής Η+ είναι 2 και, κατά συνέπεια, αυτό του Η2Το θα είναι 1:
3 ΟΧΙ2- + 2 Ω+ → 1 ΟΧΙ3- + 2 ΟΧΙ + 1 Ω2Ο
2ο Παράδειγμα:
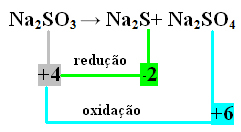
Σε αυτήν την περίπτωση, ήταν το S που υπέστη ταυτόχρονα μείωση και οξείδωση. Έτσι, όπως έγινε προηγουμένως, μπορούμε να συσχετίσουμε το NOX με τα προϊόντα και να αντιστρέψουμε τις τιμές τους, εκχωρώντας τους συντελεστές σε αυτά:
Στο2 S = ΔNox = 4 - (-2) = 6 → 6 θα είναι ο συντελεστής Na2 ΜΟΝΟ4
Στο2 ΜΟΝΟ4= ΔNox = 6 - 4 = 2 → 2 θα είναι ο συντελεστής Na2 μικρό
Στο2 ΜΟΝΟ3→ 2 Στο2 Υ + 6 Στο2 ΜΟΝΟ4
Δεδομένου ότι υπάρχουν 8 θείο στο 2ο άκρο, ο συντελεστής Na2 ΜΟΝΟ3 θα είναι 8:
8 ίντσες2 ΜΟΝΟ3→ 2 ίντσες2 S + 6 ίντσες2 ΜΟΝΟ4
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αντιδράσεις αυτο-οξείδωσης". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Πρόσβαση στις 28 Ιουνίου 2021.