Σύμφωνα με τον Πρώτο Νόμο της Θερμοδυναμικής, σε οποιαδήποτε θερμοδυναμική διαδικασία η ποσότητα θερμότητας Ερ λαμβανόμενο από ένα σύστημα ισούται με τη δουλειά που πραγματοποιείται από αυτό συν τη διακύμανση της εσωτερικής του ενέργειας.
Όταν η πίεση είναι σταθερή, η θερμότητα που ανταλλάσσεται από το σύστημα με το εξωτερικό μέσο χρησιμοποιείται για εργασία και για την αλλαγή της εσωτερικής ενέργειας. Σε πολλές πρακτικές καταστάσεις, τα συστήματα υπόκεινται σε ατμοσφαιρική πίεση, όπως στην περίπτωση μιας χημικής αντίδρασης. Το παραπάνω σχήμα δείχνει το PV διάγραμμα αυτού του τύπου διαδικασίας.
Σε αυτήν την περίπτωση, στην εξίσωση του Πρώτου Νόμου,
Q = τ + ΔU
κανένας από τους όρους δεν είναι μηδέν. Το έργο γράφεται ως συνάρτηση του όγκου παραλλαγής έντασηςV, όπως:
τ = P.ΔV
Για τη συγκεκριμένη περίπτωση ενός ιδανικού μονοατομικού αερίου, η ενέργεια μπορεί να γραφτεί ως εξής:

Επομένως, μπορούμε να γράψουμε τον Πρώτο Νόμο της Θερμοδυναμικής ως συνάρτηση του ΔV:


Η θερμότητα που ανταλλάσσεται με το μέσο είναι (5/2) P.ΔV και το 40% του συνόλου - που αντιστοιχεί στο P.ΔV - χρησιμοποιείται για την εκτέλεση εργασιών. και (3/2) P.ΔV, που αντιστοιχεί στο 60% του συνόλου, χρησιμοποιούνται για την αλλαγή της εσωτερικής ενέργειας. Αυτό το αποτέλεσμα ισχύει για ένα ιδανικό μονοατομικό αέριο.
Η θερμότητα σχετίζεται με τη διακύμανση της θερμοκρασίας (χρησιμοποιώντας τον ιδανικό νόμο αερίου) από:
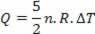
Έτσι, η παρεχόμενη θερμότητα μπορεί να υπολογιστεί από την αλλαγή της θερμοκρασίας ή από την αλλαγή του όγκου.
Από τον Domitiano Marques
Αποφοίτησε στη Φυσική
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm