Ενας ανάμιξη διαλυμάτων της ίδιας διαλυμένης ουσίας χωρίς χημική αντίδραση συνίσταται στο να συγκεντρωθούν στον ίδιο περιέκτη δύο διαλύματα με, για παράδειγμα, χλωριούχο κάλιο (Kcl). Σε αυτόν τον τύπο μίγματος, δεν θα υπάρξει ποτέ χημική αντίδραση λόγω της παρουσίας ίσων διαλυτών, δηλαδή, και οι δύο έχουν το ίδιο κατιόν και το ίδιο ανιόν. Έτσι, μπορούμε να πούμε ότι, όταν κάνουμε ένα μείγμα με αυτά τα χαρακτηριστικά, προσθέτουμε απλώς τις ποσότητες διαλυμένης ουσίας και διαλύτη που αποτελούν και τα δύο διαλύματα.
Εάν αναμίξουμε, για παράδειγμα, ένα διάλυμα 1L νερού και 4 γραμμάρια ΚΙ (ιωδιούχο κάλιο) με ένα άλλο διάλυμα 2L νερού και 6 γραμμάρια ΚΙ, θα έχουμε ένα νέο διάλυμα 3L νερού και 10 γραμμάρια ΚΙ .
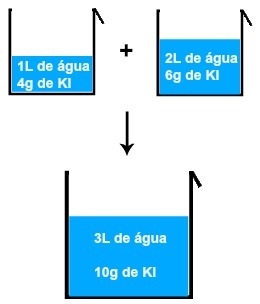
Αποτέλεσμα ανάμιξης δύο διαλυμάτων ιωδιούχου καλίου
Αναλύοντας την εικόνα, μπορούμε να συμπεράνουμε ότι τη μάζα της διαλυμένης ουσίας (m1Το πρώτο διάλυμα προστίθεται στη μάζα της διαλυμένης ουσίας (m1'') της δεύτερης λύσης, με αποτέλεσμα τη μάζα της διαλυμένης ουσίας (mφά) στην τελική λύση (Μείγμα):
Μ1«+ μ1= = μφά
Στο παράδειγμα:
4 + 6 = 10 γραμμάρια
Το ίδιο συμβαίνει με τον όγκο του νερού που υπάρχει σε κάθε διάλυμα, δηλαδή, ο όγκος του πρώτου (V ') που προστίθεται στον όγκο του δεύτερου (V' ') έχει ως αποτέλεσμα τον τελικό όγκο (V')φά):
V '+ V' = Vφά
Στο παράδειγμα:
1 + 2 = 3 λίτρα
Καθώς κάθε διάλυμα έχει ποσότητα διαλυμένης διαλυμένης ουσίας και εδώ έχουμε ένα μείγμα διαλυμάτων της ίδιας διαλυμένης ουσίας, μπορούμε στη συνέχεια, από τα παραπάνω, να προσδιορίσουμε τη συγκέντρωση (κοινή, μοριακότητα) καθενός από τα αναμεμιγμένα διαλύματα και επίσης του τελικού διαλύματος.
Επομένως, πρέπει να θυμόμαστε τους τύπους για τον υπολογισμό αυτών των συγκεντρώσεων:
Κοινή συγκέντρωση:
Γ = Μ1
Β
Μ1 = μάζα διαλυμένης ουσίας διαλύματος
V = όγκος διαλύματος
ΣΗΜΕΙΩΣΗ: απομόνωση του m1 στον τύπο, έχουμε: Μ1 = Βιογραφικό
Μοριακότητα:
Μ = Μ1
Μ1.V
Μ1 = μοριακή μάζα της διαλυμένης ουσίας.
ΣΗΜΕΙΩΣΗ: απομόνωση του m1 στον τύπο, έχουμε: Μ1 = Μ.Μ.1.V
Καθώς το μείγμα διαλυμάτων της ίδιας διαλυμένης ουσίας αντιμετωπίζει το άθροισμα της μάζας της διαλυμένης ουσίας των διαλυμάτων, μπορούμε να αντικαταστήσουμε καθεμία από τις παρατηρήσεις στην ακόλουθη έκφραση:
Μ1«+ μ1= mF
C'.V "+ C". V "= Cφά.Vφά
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
C '= κοινή συγκέντρωση του διαλύματος 1
C "= κοινή συγκέντρωση του διαλύματος 2
Εάν ο υπολογισμός του μείγματος διαλυμάτων συνεπάγεται μοριακότητα:
Μ1«+ μ1= = μφά
M'.V "+ M". V "= Mφά.Vφά
ΣΗΜΕΙΩΣΗ: Δεδομένου ότι η διαλυμένη ουσία είναι η ίδια, η μοριακή μάζα είναι η ίδια σε κάθε ένα από τα διαλύματα. Επομένως, παραμελείται στον υπολογισμό.
τώρα δείτε παραδείγματα που καλύπτουν υπολογισμούς σε ένα μείγμα διαλυμάτων της ίδιας διαλυμένης ουσίας χωρίς χημική αντίδραση:
Παράδειγμα 1: (Mackenzie-SP-Adaptada) Προσθέτοντας 600 mL διαλύματος KOH 14g / L σε συγκεκριμένο όγκο (v) διαλύματος 84 g / L της ίδιας βάσης, λαμβάνεται διάλυμα 67,2 g / L. Ο προστιθέμενος όγκος (v) του διαλύματος 84 g / L είναι:
α) 0100 mL
β) 3000 ml
γ) 2700 ml
δ) 1500 ml
ε) 1900 mL
Τα στοιχεία που παρείχε η άσκηση ήταν:
V '= 600 mL
C '= 14 g / λίτρο
V "=?
C "= 84 g / L
Βφά = ?
CF = 67,2 g / L
Πριν προσδιορίσουμε τον προστιθέμενο όγκο του διαλύματος 1, πρέπει πρώτα να προσδιορίσουμε τον τελικό όγκο με την ακόλουθη έκφραση:
V '+ V' = Vφά
600 + V "= Vφά
Αντικαθιστώντας τις τιμές που δίνονται στη μαθηματική έκφραση παρακάτω, έχουμε:
C'.V "+ C". V "= Cφά.Vφά
14. 600 + 84.V "= 67,2. (600 + V")
8400 + 84.V "= 67,2. 600 + 67.2.V "
8400 + 84.V "= 40320 + 67.2.V"
84.V "- 67.2.V" = 40320 - 8400
16.8.V "= 31920
V "= 31920
16,8
V "= 1900 mL
Παράδειγμα 2: (UFOP) Σε ογκομετρική φιάλη 1000 ml, προστέθηκαν 250 ml διαλύματος θειικού οξέος 2Μ με 300 ml διαλύματος 1Μ του ίδιου οξέος και ο όγκος συμπληρώθηκε στα 1000 ml με απεσταγμένο νερό. Προσδιορίστε τη μοριακότητα του προκύπτοντος διαλύματος.
Τα στοιχεία που παρείχε η άσκηση ήταν:
V '= 250 mL
Μ '= 2 Μ
V "= 300 mL
Μ "= 1 Μ
Βφά = 1000 ml
Μφά = ?
Για να προσδιορίσετε τη μοριακότητα της τελικής λύσης, απλώς χρησιμοποιήστε τη μαθηματική έκφραση που αντιπροσωπεύει τη διαδικασία:
M'.V "+ M". V "= Mφά.Vφά
2. 250 + 1. 300 = Μφά.1000
500 + 300 = Μφά. 1000
800 = Μφά
1000
Μφά = 0,8 mol / L
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Μείγμα διαλυμάτων της ίδιας διαλυμένης ουσίας χωρίς χημική αντίδραση". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Πρόσβαση στις 27 Ιουνίου 2021.