Η δράση ενός καταλύτη είναι βασικά η επιτάχυνση της ανάπτυξης μιας συγκεκριμένης αντίδρασης. Αυτό είναι δυνατό γιατί ο καταλύτης αλλάζει τον μηχανισμό με τον οποίο προχωρά η αντίδραση, οδηγώντας σε μια «εναλλακτική διαδρομή» που απαιτεί λιγότερη ενέργεια ενεργοποίησης για να ξεκινήσει η αντίδραση και να φτάσει στο ενεργοποιημένο σύμπλοκο.
Υπάρχουν διάφοροι τύποι κατάλυσης, ένας από τους οποίους είναι ο ετερογενής κατάλυση, που μπορεί να οριστεί ως Αυτό που συμβαίνει όταν το σύστημα έχει περισσότερες από μία φάσεις, δηλαδή τα αντιδραστήρια και τα προϊόντα βρίσκονται σε φυσική κατάσταση διαφορετική από τη φυσική κατάσταση του καταλύτη.
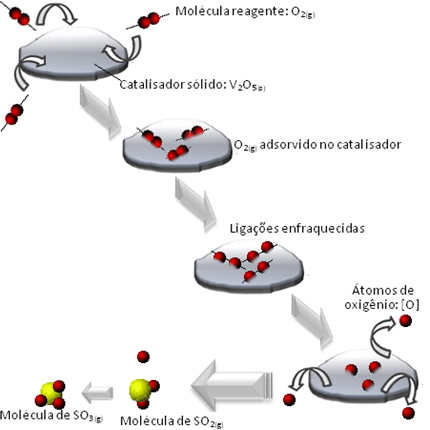
Ένα παράδειγμα που μπορούμε να αναφέρουμε είναι ένα ενδιάμεσο στάδιο σχηματισμού θειικού οξέος (Η2ΜΟΝΟ4 (υδ)). Αυτό το στάδιο συνίσταται στον σχηματισμό τριοξειδίου του θείου (SO3 (ζ)) μέσω της αντίδρασης καύσης διοξειδίου του θείου (SO2 (ζ)):
2 Ω2 (ζ) + Ο2 (ζ) → 2 λειτουργικό σύστημα3 (ζ)
Καθώς αυτή η αντίδραση εξελίσσεται τόσο αργά, χρησιμοποιείται ένας καταλύτης για να την επιταχύνει. Ένας καταλύτης που μπορεί να χρησιμοποιηθεί σε αυτήν την περίπτωση είναι το πεντοξείδιο του διναναδίου (V
2Ο5 (S)), το οποίο είναι συμπαγές. Δεδομένου ότι τα αντιδραστήρια και το προϊόν αντίδρασης είναι αέρια, θα έχουμε ένα ετερογενές σύστημα.Αλλά πώς μπορεί το πεντοξείδιο του διναδίου να επιταχύνει την αντίδραση;
Αυτό που συμβαίνει είναι ότι τα μόρια του αντιδραστηρίου οξυγόνου απορροφούνται, δηλαδή συγκρατούνται στην επιφάνεια του πεντοξειδίου του διναδίου. Αυτό προκαλεί την εξασθένιση των δεσμών των μορίων αυτού του αερίου με την πάροδο του χρόνου, γεγονός που διευκολύνει το σχηματισμό του συμπλόκου ενεργοποιείται και, κατά συνέπεια, μειώνει την ενέργεια ενεργοποίησης της αντίδρασης, αυξάνοντας τον ρυθμό ανάπτυξής της, δηλαδή ταχύτητα.
Δείτε πώς συμβαίνει αυτό στο παρακάτω διάγραμμα:
Αλλα παραδείγματα ετερογενούς κατάλυσης παρουσιάζονται παρακάτω. Σημειώστε ότι και στις δύο περιπτώσεις τα αντιδραστήρια και τα προϊόντα βρίσκονται σε αέρια, υδατική ή υγρή κατάσταση, ενώ οι καταλύτες βρίσκονται σε στερεά κατάσταση:
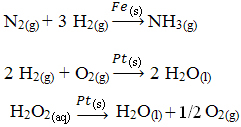
Ένα παράδειγμα ετερογενούς κατάλυσης που εμφανίζεται στην καθημερινή μας ζωή είναι αυτό των μετατροπέων καταλυτικό αυτοκίνητο, πιο γνωστό ως καταλύτες. Αυτές οι αντιρρυπαντικές συσκευές είναι επικαλυμμένες με ουσίες που λειτουργούν ως καταλύτες συνήθως ένα κράμα παλλαδίου και ροδίου (για βενζινοκινητήρες) και παλλαδίου και μολυβδαινίου (για βενζινοκινητήρες). αλκοόλ).
Μέσα σε αυτόν τον καταλύτη, εμφανίζονται χημικές αντιδράσεις στις οποίες αέρια από ατελή καύση, τα οποία είναι πιο επιβλαβή για τον άνθρωπο, μετατρέπονται σε μη τοξικά αέρια. Τα αντιδραστήρια και τα προϊόντα είναι όλα αέρια, ενώ οι καταλύτες είναι στερεά.
Για να μάθετε περισσότερα σχετικά με το λειτουργικό σύστημα αυτού του εξοπλισμού, διαβάστε το κείμενο: "Καταλυτικός μετατροπέας”.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm


