Στο διαμοριακές δυνάμεις, ονομάζεται γενικά Van der Waals Forces, υπάρχουν τρία: διπολικό που προκαλείται από διπόλη, δεσμούς υδρογόνου και μόνιμο δίπολο-μόνιμο δίπολο. Σε αυτό το κείμενο, θα εξετάσουμε μόνο την τελευταία από αυτές τις τρεις δυνάμεις:
Η εξουσία μόνιμο δίπολο-μόνιμο δίπολο, ή απλά, δίπολο-δίπολο εμφανίζεται μόνο σε πολικά μόρια, δηλαδή, εκείνα που δεν έχουν ομοιόμορφη κατανομή φορτίου κατά μήκος της επιφάνειάς του. Για να αναφέρω ένα παράδειγμα, στο μόριο του HCl (υδροχλωρικό αέριο) το ηλεκτρονικό νέφος μετατοπίζεται περισσότερο προς το άτομο χλωρίου, καθώς είναι πιο ηλεκτροαρνητικό από το υδρογόνο.
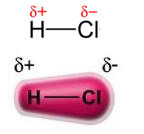
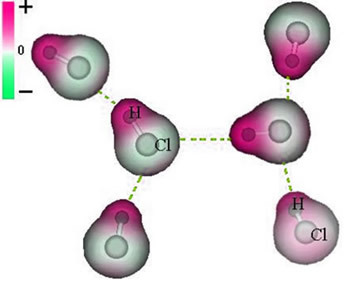
Σημειώστε ότι γύρω από το άτομο χλωρίου υπάρχει συσσώρευση ηλεκτρονίων, η οποία προκαλεί το σχηματισμό a αρνητικός πόλος, που συμβολίζεται με το ελληνικό γράμμα δέλτα (-δ). Ως αποτέλεσμα, στην περιοχή γύρω από το άτομο υδρογόνου α θετικός πόλος (+δ), καθώς έχει χαμηλή ηλεκτρονική πυκνότητα. Το μόριο HCl στη συνέχεια αποτελεί ένα ηλεκτρικό δίπολο και, επομένως, όταν έρχεστε σε επαφή με άλλα γειτονικά μόρια HCl, υπάρχει μια δύναμη έλξης μεταξύ των αντίθετων πόλων των μορίων, όπως φαίνεται παρακάτω:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Αυτή η ελκυστική δύναμη, η οποία καθιερώνεται μεταξύ του αρνητικού άκρου του διπόλου ενός μορίου με το θετικό άκρο του διπόλου ενός άλλου μορίου, αποτελεί τη διπολική-διπολική δύναμη..
Έτσι, όπως λέει το όνομα, το δίπολο είναι μόνιμο, επομένως εμφανίζεται μόνο σε πολικές ενώσεις. Και όσο υψηλότερη είναι η πολικότητα ενός μορίου, τόσο πιο έντονη είναι η αλληλεπίδραση της διπολικής διπόλης στην ουσία.
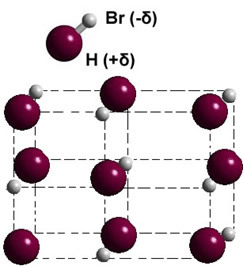
Εάν βρίσκεται στη στερεά φάση, ο σχηματισμός του μόνιμου διπόλου καθοδηγεί τη θέση κάθε μορίου στο διάστημα, σχηματίζοντας διπολικοί κρύσταλλοι; όπως στην περίπτωση του υδροβρωμίου που απεικονίζεται παρακάτω:
Άλλα παραδείγματα πολικών ουσιών που έχουν διπολική διπολική αντοχή μεταξύ των μορίων τους είναι:2S, CO, HCCI3, ΜΟΝΟ2.
Αυτή η διαμοριακή δύναμη είναι μέτρια ένταση, καθώς είναι ισχυρότερη από την προκαλούμενη από δίπολο δύναμη που προκαλείται από δίπολο έλξης, αλλά λιγότερο έντονη από τον δεσμό υδρογόνου. Αυτός είναι ο λόγος για τον οποίο τα σημεία τήξεως και βρασμού τους είναι υψηλότερα από εκείνα των ουσιών που έχουν προκαλούμενη διπολική αντοχή. Δεδομένου ότι η μόνιμη διπολική δύναμη είναι ισχυρότερη, είναι απαραίτητο να παρέχεται περισσότερη ενέργεια για την διάσπαση των αλληλεπιδράσεων των μορίων της.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Διαμοριακή διπολική διπολική δύναμη" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Πρόσβαση στις 27 Ιουνίου 2021.
ε) λειτουργικό σύστημα2, HBr, HCl, Η2Ο.
γ) Γνωρίζοντας ότι οι θερμοκρασίες βρασμού του CH3Cl και CH3Είμαι 24,0 ° C και 42,4 ° C, αντίστοιχα, υποδεικνύουν ποια ένωση παρουσιάζει, στην υγρή φάση, πιο έντονες διαμοριακές δυνάμεις.