Στο κείμενο "Τίτλος ή ποσοστό μάζας«Είδαμε πώς να υπολογίσουμε την αναλογία μεταξύ της μάζας της διαλυμένης ουσίας και της μάζας του διαλύματος, για στερεά, υγρά και αέρια διαλύματα. Σε αυτό το κείμενο, ωστόσο, θα δούμε ότι είναι επίσης δυνατό να υπολογιστεί ο τίτλος ως προς τον όγκο, για λύσεις με υγρά ή αέρια συστατικά.

Ο τίτλος σε όγκο μπορεί να υπολογιστεί με την έκφραση:
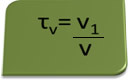
Θεωρήστε ως παράδειγμα ένα υδατικό διάλυμα αιθυλικής αλκοόλης που χρησιμοποιείται ως αντισηπτικό και απολυμαντικό, το οποίο ήταν παρασκευάστηκε προσθέτοντας 70 mL καθαρού αλκοόλ σε αρκετό νερό για να φθάσει σε όγκο 100 mL λύση. Έτσι έχουμε:
τ = 70 ml = 0,7
100 ml
Μπορούμε επίσης να εκφράσουμε τον τίτλο και σε ποσοστό, πολλαπλασιάζοντας το αποτέλεσμα με 100%. Έτσι, σε αυτήν την περίπτωση έχουμε ένα διάλυμα αιθυλικής αλκοόλης 70%, πράγμα που σημαίνει ότι από κάθε 100 μονάδες όγκου του διαλύματος, 70 μονάδες όγκου είναι αλκοόλη.
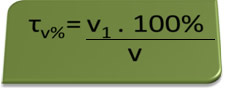
Στην παρακάτω περίπτωση, έχουμε ένα διάλυμα αιθυλικής αλκοόλης 70% σε όγκο διαλύματος 250 mL. που σημαίνει ότι 175 mL είναι αλκοόλ, σύμφωνα με τους υπολογισμούς:
100 mL 70 mL αλκοόλ
250 mL x
x = 70. 250
100
X = 175 mL αλκοόλ

Ωστόσο, δεν μπορούμε να πούμε ότι σε αυτήν την περίπτωση έχουμε 75 mL (250-175) νερού. Σε αντίθεση με τον τίτλο μάζας, στον οποίο μπορούμε να προσθέσουμε τη μάζα του διαλύτη στη μάζα της διαλυμένης ουσίας για να βρούμε τη μάζα του διαλύματος, αυτό δεν μπορεί να γίνει σε σχέση με τον τίτλο όγκου.

Αυτό σημαίνει ότι ο όγκος του διαλύματος δεν είναι ίσος με το άθροισμα του όγκου του διαλύτη και του όγκου της διαλυμένης ουσίας (αν και συχνά η διαφορά μπορεί να θεωρηθεί αμελητέα). Αυτό συμβαίνει επειδή οι διαμοριακές δυνάμεις που υπάρχουν σε αυτά τα υγρά επηρεάζουν τον τελικό όγκο.
Στην περίπτωση του προαναφερθέντος διαλύματος, της αιθυλικής αλκοόλης, για παράδειγμα, όταν αναμιγνύουμε αλκοόλη με νερό, υπάρχει μια συστολή του συνολικού όγκου του διαλύματος. Δηλαδή, ο τελικός όγκος θα είναι μικρότερος από ότι αν προσθέσαμε μόνο τον όγκο αλκοόλ και νερού. Αυτό συμβαίνει επειδή τα μόρια αλκοόλης δημιουργούν δεσμούς ή δεσμούς υδρογόνου με τα μόρια νερού, μειώνοντας τα κενά μεταξύ τους.
Επομένως, σε αυτήν και σε άλλες περιπτώσεις, ο όγκος του διαλύματος πρέπει να μετρηθεί πειραματικά όταν δεν παρέχεται στην άσκηση.
Το ποσοστό κατ 'όγκο χρησιμοποιείται ευρέως σε περιπτώσεις αλκοολούχων ποτών και εμπορικού αλκοόλ, όπως αναφέρεται παραπάνω. Δείτε δύο σημαντικές εφαρμογές αυτού του υπολογισμού:
- Breathalyzer: ο αναπνευστήρας μετρά τη συγκέντρωση αιθυλικής αλκοόλης στο αίμα και στη Βραζιλία απαγορεύεται σε οποιονδήποτε να οδηγεί οποιοδήποτε τύπο οχήματος με περιεκτικότητα σε αλκοόλη αίματος ίση ή μεγαλύτερη από 0,1% σε όγκο. Ένα άτομο με αυτήν την περιεκτικότητα σε αλκοόλ έχει, για κάθε λίτρο αίματος, 1 mL αλκοόλ, όπως φαίνεται από τους ακόλουθους υπολογισμούς:
τv%=Β1. 100%
β
0,1 % = Β1. 100%
1L
Β1 = 0,1% → V1 = 0,001 L = 1 mL
100%

- Περιεκτικότητα σε αιθανόλη σε βενζίνη: Στη Βραζιλία, η βενζίνη ρυθμίζεται με την προσθήκη αιθανόλης. Αλλά η περιεκτικότητα σε αιθανόλη στη βενζίνη πρέπει να είναι το πολύ 24% κατ 'όγκο άνυδρης αλκοόλης (δεδομένου ότι η βενζίνη πρέπει να είναι χωρίς νερό). Όσο περισσότερη αιθανόλη προστίθεται στη βενζίνη, τόσο περισσότερο το χρώμα του καυσίμου γίνεται ελαφρύτερο και αυξάνεται η πυκνότητά του.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm
