Δεδομένου ότι υπάρχουν χιλιάδες οργανικές ενώσεις, το φαινόμενο του ισομερισμού μπορεί να λάβει διάφορες μορφές. Επομένως, ο ισομερισμός μπορεί βασικά να ταξινομηθεί σε δύο τύπους: επίπεδος ή συνταγματικός ισομερισμός και διαστημικός ισομερισμός ή στερεοϊσομερισμός. Κάθε αναφερόμενος τύπος μπορεί να υποδιαιρεθεί, όπως φαίνεται στο παρακάτω διάγραμμα:
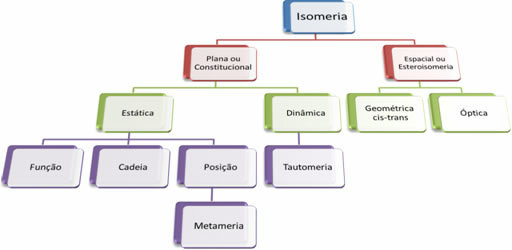
Δείτε κάθε περίπτωση:
1. Επίπεδο ή συνταγματικό ισομερισμό: Τα ισομερή αυτού του τύπου έχουν τον ίδιο μοριακό τύπο και διαφοροποιούνται από επίπεδες δομικούς τύπους. Υπάρχουν πέντε περιπτώσεις ισομερισμού επιπέδου: λειτουργία, αλυσίδα, θέση, μεταμερισμός και ταυτομερισμός.
1.1.Λειτουργικός ή λειτουργικός ισομερισμός: Η διαφορά μεταξύ των ισομερών είναι στη λειτουργική ομάδα.
Παράδειγμα: Μοριακός τύπος Γ3Η6Ο
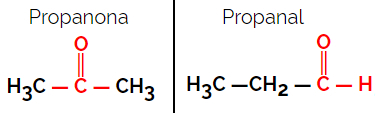
Σημειώστε ότι η προπανόνη προέρχεται από την ομάδα κετόνης και η προπανόλη προέρχεται από την ομάδα αλδεϋδης.
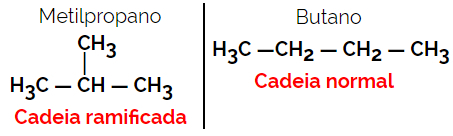
1.2. Αλυσίδα ή σκελετικά ισομερή: Η διαφορά μεταξύ των ισομερών είναι στον τύπο της αλυσίδας. Για παράδειγμα, ένα ισομερές είναι ανοιχτής αλυσίδας και το άλλο κλειστή αλυσίδα, ή ένα είναι κανονικής αλυσίδας και η άλλη διακλαδισμένη αλυσίδα, ή το ένα είναι ομοιογενής αλυσίδα και το άλλο είναι ετερογενής αλυσίδα.
Παράδειγμα: Μοριακός τύπος Γ4Η10
1.3.Ισομερισμός θέσης ή θέσης: Η διαφορά είναι στη θέση ενός ακόρεστου, μιας λειτουργικής ομάδας, ενός ετεροάτομου ή ενός υποκαταστάτη.
Παράδειγμα: Μοριακός τύπος Γ4Η6

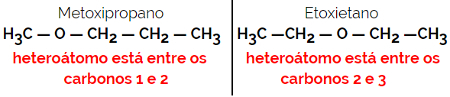
1.4.Ισομερισμός αποζημίωσης ή Metamery: Είναι ένας ειδικός τύπος ισομερισμού θέσης, όπου η διαφορά είναι η θέση του ετεροάτομου.
Παράδειγμα: Μοριακός τύπος Γ4Η10Ο
1.5.Δυναμική Isomery ή Tautomery: Είναι ένας ειδικός τύπος ισομερισμού λειτουργίας, στον οποίο τα ισομερή συνυπάρχουν σε δυναμική ισορροπία σε διάλυμα. Οι δύο κύριοι τύποι ταυτομερών είναι μεταξύ κετόνης και ενόλης (ισορροπία κετονολόλης) και μεταξύ αλδεΰδης και ενόλης (ισορροπία αλδοενόλης).
Παράδειγμα: Μοριακός τύπος Γ3Η6Ο
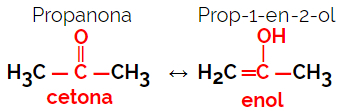
2. Διαστημικός ισομερισμός ή Στεροϊσομερισμός: Σε αυτήν την περίπτωση, η διαφορά μεταξύ των ισομερών μπορεί να απεικονιστεί μόνο μέσω του προσανατολισμού των ατόμων τους στο διάστημα. Υπάρχουν δύο τύποι στερεοϊσομερισμού: γεωμετρικός ισομερισμός και οπτικός ισομερισμός.
2.1.Γεωμετρικά ή cis-trans ισομερή: Η διαφορά είναι ότι το ισομερές ονομάζεται ως cis έχει τα ίδια προσδέματα άνθρακα σε διπλό δεσμό ή σε κυκλικές ενώσεις στην ίδια πλευρά του επιπέδου. Τα ισομερή προσδέματα τρανς βρίσκονται σε αντίθετες πλευρές.
Παράδειγμα: Μοριακός τύπος Γ2Η2Κλ2

Αυτές οι ενώσεις ονομάζονται στερεοϊσομερή.
2.2.Οπτικό ισομερές: Εμφανίζεται όταν τα ισομερή είναι σε θέση να εκτρέψουν μια ακτίνα πολωμένου φωτός. Εάν κάμπτει την πολωμένη δέσμη φωτός προς τα αριστερά, είναι ένα λεβοτοριακό ισομερές, αλλά αν κάμπτει προς τα δεξιά ονομάζεται δεξιόστροφο ισομερές.
Παράδειγμα:
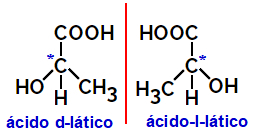
Τα ασύμμετρα μόρια όπως αυτά που εμφανίζονται παραπάνω, τα οποία είναι καθρέφτες μεταξύ τους και δεν είναι υπερθετικά, ονομάζονται εναντιομερή.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm