έχουμε ένα ανάμιξη διαλυμάτων με διαφορετικές διαλυτές ουσίες χωρίς χημική αντίδραση όταν δύο ή περισσότερα μείγματα έχουν κοινές ουσίες με το ίδιο ιόν (είτε το ίδιο κατιόν είτε το ίδιο ανιόν). Όπως στο παρακάτω παράδειγμα:
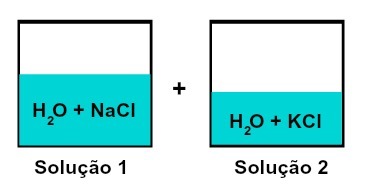
Μείγμα διαλυμάτων που έχουν διαφορετικές διαλυτές ουσίες
Το διάλυμα 1 είναι νερό και χλωριούχο νάτριο (NaCl), ενώ το διάλυμα 2 περιέχει νερό και χλωριούχο κάλιο (KCl). Όταν αναμιγνύουμε μαζί έχουμε ένα ανάμιξη διαφόρων διαλυμένων διαλυμάτων χωρίς χημική αντίδραση, επειδή και τα δύο άλατα που χρησιμοποιούνται έχουν το ανιόν χλωρίου (Cμεγάλο-).
1- Χαρακτηριστικά μιγμάτων διαφορετικών διαλυμένων διαλυμάτων χωρίς χημική αντίδραση
Όταν πραγματοποιείται ένα μείγμα διαλυμάτων που έχουν διαφορετικές διαλυτές ουσίες χωρίς χημική αντίδραση, τα παρακάτω χαρακτηριστικά ελέγχονται πάντα:
Η μάζα καθενός από τις διαλυμένες ουσίες δεν αλλάζει (εάν στο διάλυμα 1 έχουμε 10 g διαλυμένης ουσίας και σε 2, 30 g, για παράδειγμα, μετά την ανάμιξη θα έχουμε την ίδια μάζα κάθε διαλυμένης ουσίας),
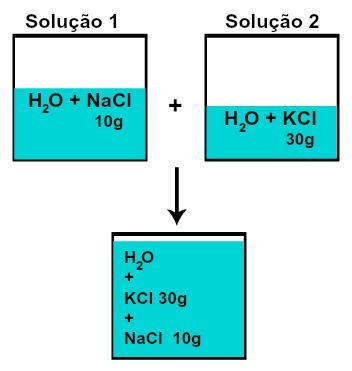
Μάζα καθεμίας από τις διαλυτές ύλες μετά την ανάμιξη διαλυμάτων χωρίς χημική αντίδραση
Ο ποσότητα ύλης (ιδ) καθεμία από τις διαλυμένες ουσίες δεν αλλάζει (εάν στο διάλυμα 1 έχουμε 5 mol διαλυμένης ουσίας και σε 2, 4 mol, για παράδειγμα, μετά την ανάμιξη θα έχουμε την ίδια ποσότητα ύλης εκάστης),
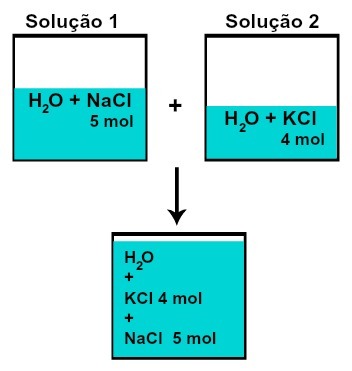
Αριθμός γραμμομορίων καθενός από τις διαλυτές ύλες μετά από ανάμιξη διαλυμάτων χωρίς χημική αντίδραση
Ο όγκος της τελικής λύσης, Vφά, είναι το αποτέλεσμα του αθροίσματος των όγκων καθενός από τα αναμεμιγμένα διαλύματα (εάν στο διάλυμα 1 έχουμε 200 mL και στο διάλυμα 2, 300 mL, για παράδειγμα, μετά την ανάμιξη θα έχουμε 500 mL όγκου),
Βφά = V1 + V.2
2- Τύποι που χρησιμοποιούνται σε υπολογισμούς ανάμιξης διαλυμάτων διαφορετικών διαλυτών χωρίς χημική αντίδραση.
Όπως σε αυτόν τον τύπο μείγματος έχουμε μόνο μια αύξηση στην ποσότητα του διαλύτη σε σχέση με κάθε ένα από τα διαλυτές ουσίες, πρέπει να υπολογίσουμε την τελική συγκέντρωση καθενός από τις διαλυμένες ουσίες χρησιμοποιώντας τα ακόλουθα εκφράσεις:
α) Προς κοινή συγκέντρωση (ΝΤΟ)
Για τη λύση 1: ο πολλαπλασιασμός της συγκέντρωσης του διαλύματος 1 με τον όγκο του ισούται με την τελική συγκέντρωση πολλαπλασιαζόμενος με τον όγκο του
ΝΤΟ1.V1 = Γφά.Vφά
Για τη λύση 2: ο πολλαπλασιασμός της συγκέντρωσης του διαλύματος 2 με τον όγκο του ισούται με την τελική συγκέντρωση επί τον όγκο του
ΝΤΟ2.V2 = Γφά.Vφά
β) Προς συγκέντρωση σε ποσότητα ύλης ή μοριακότητα (Μ)
Για τη λύση 1:
Μ1.V1 = Μφά.Vφά
Για τη λύση 2:
Μ2.V2 = Μφά.Vφά
γ) Συγκέντρωση σε ποσότητα ύλης κάθε ιόντος που υπάρχει στο διάλυμα
Εάν πρέπει να προσδιορίσουμε τη συγκέντρωση ενός ή όλων των ιόντων που υπάρχουν στην τελική λύση, πρέπει:
1º: Θυμηθείτε ότι η συγκέντρωση ιόντων δίνεται από τον πολλαπλασιασμό της συγκέντρωσης (Μ), της διαλυμένης ουσίας από την οποία προέρχεται, από τον δείκτη του στον τύπο ουσίας. Έτσι, για το ιόν Y, στην ουσία 1, XY3, η συγκέντρωση θα είναι:
[Υ]1 = 3. Μ
Όσον αφορά το solute2, ZY, η συγκέντρωση του Y θα δοθεί από:
[Υ]2 = 1. Μ
2º: Εάν έχουμε περισσότερες από μία διαλυμένες ουσίες που απελευθερώνουν το ίδιο ιόν, για παράδειγμα, το XY διαλύεται3 και ZY, που έχουν το ίδιο ιόν Y, η συγκέντρωση αυτού του ιόντος στο τελικό διάλυμα δίνεται από το άθροισμα των συγκεντρώσεών του για κάθε διαλυμένη ουσία:
[Υ]φά = [Υ]1 + [Υ]2
3- Παραδείγματα υπολογισμών που περιλαμβάνουν ανάμιξη διαλυμάτων διαφορετικών διαλυμάτων χωρίς χημική αντίδραση
Παράδειγμα 1: (PUC SP) Σε ένα ποτήρι, αναμίχθηκαν 200 ml υδατικού διαλύματος χλωριούχου ασβεστίου (CaCl)2συγκέντρωσης 0,5 mol. μεγάλο–1 και 300 ml διαλύματος 0,8 mol. μεγάλο–1 χλωριούχου νατρίου (NaCl). Το ληφθέν διάλυμα έχει συγκέντρωση ανιόντος χλωριδίου περίπου:
α) 0,34 mol. μεγάλο–1
β) 0,65 mol. μεγάλο–1
γ) 0,68 mol. μεγάλο–1
δ) 0,88 mol. μεγάλο–1
ε) 1,3 mol. μεγάλο–1
Τα στοιχεία που παρείχε η άσκηση ήταν:
Λύση 1:
Όγκος (V1): 200 ml
Μοριακή συγκέντρωση (Μ1): 0,5 mol. μεγάλο–1
Λύση 2:
Όγκος (V2): 300 ml
Μοριακή συγκέντρωση (Μ2): 0,8 mol. μεγάλο–1
Για τον προσδιορισμό της συγκέντρωσης των χλωριούχων ανιόντων (Cl-), πρέπει να ακολουθήσουμε αυτά τα βήματα:
Βήμα 1: υπολογίστε τον όγκο της τελικής λύσης
Βφά = V1 + V.2
Βφά = 200 + 300
Βφά = 500 ml
Βήμα 2: Υπολογίστε τη μοριακή συγκέντρωση του τελικού διαλύματος σε σχέση με τη διαλυμένη ουσία CaCl2, χρησιμοποιώντας την παρακάτω έκφραση:
Μ1.V1 = Μφά.Vφά
0,5.200 = Μφά.500
100 = Μφά.500
100 = Μφά
500
Μφά = 0,2 mol. μεγάλο–1
Βήμα 3: Υπολογίστε τη μοριακή συγκέντρωση του χλωριούχου [Cl-]1, στο τελικό διάλυμα, από τη διαλυμένη ουσία CaCl2, χρησιμοποιώντας την παρακάτω έκφραση:
ΣΗΜΕΙΩΣΗ: Στον τύπο έχουμε τον πολλαπλασιασμό της μοριακότητας με 2 επειδή έχουμε τον δείκτη 2 σε Cl, στον τύπο διαλυμένης ουσίας CaCl2.
[Κλ-]1 = 2.Μφά
[Κλ-]1 = 2. 0,2
[Κλ-]1 = 0,4 mol. μεγάλο–1
Βήμα 4: Υπολογίστε τη μοριακή συγκέντρωση του τελικού διαλύματος σε σχέση με τη διαλυμένη ουσία NaCl, χρησιμοποιώντας την παρακάτω έκφραση:
Μ2.V2 = Μφά.Vφά
0,8,300 = Μφά.500
240 = Μφά.500
240 = Μφά
500
Μφά = 0,48 mol. μεγάλο–1
Βήμα 5: Υπολογίστε τη μοριακή συγκέντρωση χλωριούχου, [Cl-]2, στο τελικό διάλυμα, από τη διαλυμένη ουσία NaCl, χρησιμοποιώντας την παρακάτω έκφραση:
ΣΗΜΕΙΩΣΗ: Στον τύπο έχουμε τον πολλαπλασιασμό της μοριακότητας κατά 1 επειδή έχουμε τον δείκτη 1 σε Cl, στον τύπο για τη διαλυμένη NaCl.
[Κλ-]2 = 1. Μφά
[Κλ-]2 = 1. 0,48
[Κλ-]2 = 0,48 mol. μεγάλο–1
Βήμα 6: Υπολογίστε τη συνολική ποσότητα ιόντων χλωρίου στο τελικό διάλυμα
Για να το κάνετε αυτό, απλώς προσθέστε τις μοριακές συγκεντρώσεις χλωριδίων για καθεμία από τις διαλυτές ουσίες στα βήματα 3 και 5:
[Κλ-]φά = [Cl-]1+ [Cl-]2
[Κλ-]φά = 0,4 + 0,48
[Κλ-]φά = 0,88 mol. μεγάλο–1
Παράδειγμα 2: Σε διάλυμα 500 ml 6 mol / L ΚΟΗ προστέθηκαν 300 ml διαλύματος Κ.2ΜΟΝΟ3 3 mol / L. Ποια είναι η συγκέντρωση καθενός από τις διαλυτές ουσίες στο προκύπτον μείγμα
α) 3,75 και 3,0 mol / L
β) 3,75 και 1,215 mol / L
γ) 4,5 και 1,125 mol / L
δ) 3,75 και 1,125 mol / L
ε) 4.5 και 1.215 mol / L
Τα στοιχεία που παρείχε η άσκηση ήταν:
Λύση 1:
Όγκος (V1): 500 ml
Μοριακή συγκέντρωση (Μ1): 6 mol. μεγάλο–1
Λύση 2:
Όγκος (V2): 300 ml
Μοριακή συγκέντρωση (Μ2): 3 mol. μεγάλο–1
Για τον προσδιορισμό της συγκέντρωσης των χλωριούχων ανιόντων (Cl-), πρέπει να ακολουθήσουμε αυτά τα βήματα:
Βήμα 1: υπολογίστε τον όγκο της τελικής λύσης
Βφά = V1 + V.2
Βφά = 500 + 300
Βφά = 800 ml
Βήμα 2: Υπολογίστε τη μοριακή συγκέντρωση του τελικού διαλύματος σε σχέση με τη διαλυμένη ουσία KOH, χρησιμοποιώντας την παρακάτω έκφραση:
Μ1.V1 = Μφά.Vφά
6,500 = Μφά.800
3000 = Μφά.800
3000 = Μφά
800
MF = 3,75 mol. μεγάλο–1
Βήμα 3: Υπολογίστε τη μοριακή συγκέντρωση του τελικού διαλύματος σε σχέση με τη διαλυμένη Κ2ΜΟΝΟ3, χρησιμοποιώντας την παρακάτω έκφραση:
Μ2.V2 = Μφά.Vφά
3.300 = Μφά.800
900 = Μφά.800
900 = Μφά
800
Μφά = 1,125 mol. μεγάλο–1
Από μένα. Diogo Lopes Dias
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm
