Ένα διάλυμα είναι ένα ομοιογενές μείγμα δύο ή περισσότερων ουσιών.. Όπως, για παράδειγμα, ένα διάλυμα άλατος (διαλυμένη) διαλυμένη σε νερό (διαλύτης).

Ειδικά στα χημικά εργαστήρια και τις βιομηχανίες, αυτή η διαδικασία είναι πολύ σημαντική, επειδή ο φαρμακοποιός πρέπει να προετοιμάσει λύσεις με γνωστές συγκεντρώσεις. Επιπλέον, σε πειραματικές δραστηριότητες, χρησιμοποιούνται διαλύματα με πολύ χαμηλές συγκεντρώσεις, έτσι ένα δείγμα του συμπυκνωμένου διαλύματος αραιώνεται στην επιθυμητή συγκέντρωση.
Σε καθημερινή βάση, αρκετές φορές, χωρίς καν να το συνειδητοποιούμε, πραγματοποιούμε τη διαδικασία αραίωσης λύσεων. Για παράδειγμα, η συσκευασία προϊόντων καθαρισμού και οικιακής υγιεινής, όπως απολυμαντικά, συνιστά να αραιωθούν πριν από τη χρήση. Ορισμένοι κατασκευαστές προτείνουν στις ετικέτες του προϊόντος να αραιωθεί με νερό σε αναλογία 1 έως 3, δηλαδή, για κάθε μέρος του προϊόντος, πρέπει να προστεθούν 3 μέρη νερού. Αυτό γίνεται επειδή το προϊόν είναι πολύ συμπυκνωμένο και ισχυρό και μπορεί να βλάψει το μέρος όπου θα εφαρμοστεί εάν δεν αραιωθεί με τον σωστό τρόπο. Από την άλλη πλευρά, εάν το αραιώσετε περισσότερο από όσο θα έπρεπε, μπορείτε να χάσετε χρήματα, επειδή το προϊόν δεν θα επιτύχει το επιθυμητό αποτέλεσμα.

Ένα άλλο παράδειγμα είναι όταν φτιάχνουμε χυμούς. Οι ετικέτες πολλών συμπυκνωμάτων χυμού υποδεικνύουν ότι ένα ποτήρι χυμό πρέπει να αραιωθεί ή να αναμιχθεί με 5 ποτήρια νερό. Έτσι, ο χυμός είναι «ασθενέστερος», δηλαδή λιγότερο συμπυκνωμένος.
Φανταστείτε ότι έχετε αραιώσει έναν τέτοιο χυμό σε 3 λίτρα νερού. Εάν η αρχική συγκέντρωση χυμού ήταν 40 g / L, αυτό σημαίνει ότι είχε μια μάζα 40 g για κάθε λίτρο διαλύτη. Αλλά επειδή θα έχουμε 3 L, η μάζα θα διαιρεθεί με 3 και η συγκέντρωση θα είναι τότε περίπου 13, 33 g / L ή 13 γραμμάρια για κάθε λίτρο διαλύματος. Ωστόσο, σε ολόκληρη τη λύση η μάζα της 40g διαλυμένης ουσίας παραμένει.
Ο υπολογισμός αυτής της νέας συγκέντρωσης μπορεί να γίνει ως εξής:
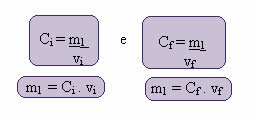
Όπου οι δείκτες i και f αντιπροσωπεύουν, αντιστοίχως, τις αρχικές και τελικές τιμές. Δεδομένου ότι η τιμή του m1 δεν έχει αλλάξει, μπορούμε να εξισώσουμε τις εξισώσεις:
ΝΤΟΕγώ. βΕγώ = Γφά. βφά
Αντικαθιστώντας τις τιμές που έχουμε, σύμφωνα με το προηγούμενο παράδειγμα, σημειώστε:
Αρχική λύση:
ΝΤΟΕγώ: 40g / L
m1: 40γρ
βΕγώ: 1L
ΤΕΛΙΚΗ λυση:
ΝΤΟφά: ?
m1: 40γρ
βφά: 3L
ΝΤΟΕγώ. βΕγώ = Γφά. βφά
(40 g / L). (1 L) = Cφά. 3L
ΝΤΟφά = 40 g / L
3
ΝΤΟφά = 13,333 g / λίτρο
Το ίδιο σκεπτικό ισχύει επίσης για τη μοριακή συγκέντρωση (M) και για το ποσοστό κατά μάζα της διαλυμένης ουσίας ή του τίτλου (T):
ΜΕγώ. βΕγώ = Μφά. βφά και ΤΕγώ. βΕγώ = Τφά. βφά
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm