Ο διαλυτότητα ή συντελεστής διαλυτότητας, Είναι μια φυσική ιδιότητα της ύλης που καθορίζεται πρακτικά στο εργαστήριο. Σχετίζεται με την ικανότητα που ονομάζεται ένα υλικό διαλυτό, δώρα για διάλυση από άλλο, το διαλυτικό μέσο.
Όσον αφορά τη διαλυτότητα, οι διαλυτές ουσίες μπορούν να ταξινομηθούν ως εξής:
Διαλυτά: εκείνα που διαλύονται στον διαλύτη. Το χλωριούχο νάτριο (διαλυμένη ουσία), για παράδειγμα, είναι διαλυτό στο νερό (διαλύτης).
Ελαφρώς διαλυτό: εκείνα που έχουν δυσκολία στη διάλυση του διαλύτη. Αυτή είναι η περίπτωση του υδροξειδίου του ασβεστίου [Ca (OH)2] (διαλυμένη ουσία) σε νερό.
Αδιάλυτα: αυτά δεν διαλύονται στον διαλύτη. Η άμμος (διαλυμένη ουσία), για παράδειγμα, είναι αδιάλυτη στο νερό.
Ο διαλυτότητα σχετίζεται πολύ με την προετοιμασία του λύσεις (ομοιογενή μείγματα), επειδή, για να ληφθεί ένα διάλυμα, είναι απαραίτητο η διαλυμένη ουσία που χρησιμοποιείται να είναι διαλυτή στον διαλύτη.
Παράγοντες που επηρεάζουν τη διαλυτότητα
Ακόμη και όταν η διαλυμένη ουσία είναι διαλυτή στον διαλύτη, υπάρχουν ορισμένοι παράγοντες που μπορούν να επηρεάσουν την ικανότητα της διαλυμένης ουσίας να διαλύεται. Είναι αυτοί:
α) Σχέση μεταξύ της ποσότητας της διαλυμένης ουσίας και του διαλύτη
Ο διαλύτης έχει πάντα ένα όριο διαλυμένης ουσίας που μπορεί να διαλυθεί. Εάν αυξήσουμε την ποσότητα του διαλύτη διατηρώντας ταυτόχρονα την ποσότητα της διαλυμένης ουσίας, ο διαλύτης τείνει να διαλύσει όλη τη διαλυμένη ουσία που χρησιμοποιείται.
ΣΙ) Θερμοκρασία
Η θερμοκρασία είναι ο μόνος φυσικός παράγοντας ικανός να τροποποιήσει τη διαλυτότητα ενός διαλύτη σε σχέση με μια δεδομένη διαλυμένη ουσία. Αυτή η τροποποίηση εξαρτάται από τη φύση της διαλυμένης ουσίας, όπως θα δούμε παρακάτω:
ενδοθερμική διαλυμένη ουσία: είναι αυτό που καταφέρουμε να διαλύσουμε μεγαλύτερη μάζα, αρκεί ο διαλύτης να είναι σε θερμοκρασία υψηλότερη από τη θερμοκρασία δωματίου. Όσο πιο ζεστός είναι ο διαλύτης, τόσο πιο διαλυμένη θα διαλυθεί.
Παράδειγμα: Είναι δυνατόν να διαλυθεί μεγαλύτερη ποσότητα αλεσμένου καφέ όταν το νερό είναι ζεστό.
Εξωθερμική διαλυμένη ουσία: είναι αυτό που καταφέρουμε να διαλύσουμε μεγαλύτερη μάζα, αρκεί ο διαλύτης να είναι σε θερμοκρασία χαμηλότερη από τη θερμοκρασία δωματίου. Όσο πιο κρύος είναι ο διαλύτης, τόσο πιο διαλυμένη θα διαλυθεί.
Παράδειγμα: Είναι δυνατόν να διαλυθεί μεγαλύτερη ποσότητα διοξειδίου του άνθρακα όταν η σόδα είναι κρύα.
Τρόποι προσδιορισμού της διαλυτότητας
Καθώς η διαλυτότητα είναι μια ιδιότητα που προσδιορίζεται με πειραματικό τρόπο, τα υλικά, γενικά, έχουν ήδη αξιολογηθεί η διαλυτότητά τους στους πιο διαφορετικούς διαλύτες. Έτσι, μπορούμε να έχουμε πρόσβαση στη διαλυτότητα μιας διαλυμένης ουσίας σε έναν συγκεκριμένο διαλύτη ως εξής:
α) Ανάλυση πίνακα
Συχνά, ο μαθητής μπορεί να βρει διαλυτότητα από την ερμηνεία ενός πίνακα. Δείτε το ακόλουθο παράδειγμα:
Παράδειγμα: (UEPG - προσαρμοσμένο) Ο παρακάτω πίνακας δείχνει τη διαλυτότητα του άλατος Li2CO3 σε 100 γραμμάρια νερού.

Ο πίνακας παρουσιάζει τις τιμές μάζας σε γραμμάρια Li2CO3 που μπορεί να διαλυθεί σε 100 γραμμάρια νερού, από 0 ΟC έως 50 ΟΝΤΟ. Μπορούμε να δούμε ότι όσο πιο ζεστό είναι το νερό, τόσο λιγότερο Li2CO3 διαλύεται. Επομένως, Λι2CO3 Είναι μια εξώθερμη διαλυμένη ουσία (θα διαλυθεί περισσότερο εάν το νερό είναι κρύο).
β) Ανάλυση γραφήματος
Η διαλυτότητα μπορεί να εκτιμηθεί ερμηνεύοντας ένα γράφημα. Για να το κάνετε αυτό, απλώς προσδιορίστε τη θερμοκρασία, γυρίστε την στην καμπύλη και μετά γυρίστε την καμπύλη στον άξονα y, που είναι η μάζα σε γραμμάρια διαλυμένης ουσίας που θα διαλυθεί.
Παράδειγμα: (UFTM - προσαρμοσμένο) Το γράφημα δείχνει την καμπύλη διαλυτότητας ενός άλατος AX2.
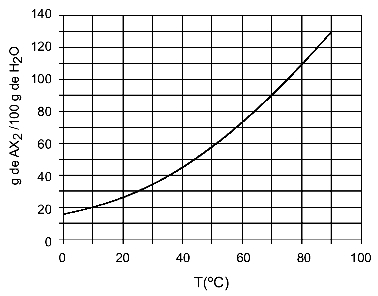
Το γράφημα αναφέρει ότι, στον άξονα y, η ποσότητα νερού (διαλύτης) είναι 100 γραμμάρια. Για διαλυμένη AX2, θα καθορίσουμε την ποσότητα νερού στις ακόλουθες θερμοκρασίες:
30ΟΝΤΟ: Όταν ενεργοποιούμε τη θερμοκρασία 30ΟC στην καμπύλη και μετά στην καμπύλη στον άξονα y, έχουμε ότι, σε αυτήν τη θερμοκρασία, τα 100 γραμμάρια νερού μπορούν να διαλύσουν περίπου 35 γραμμάρια διαλυμένης ΑΧ2.
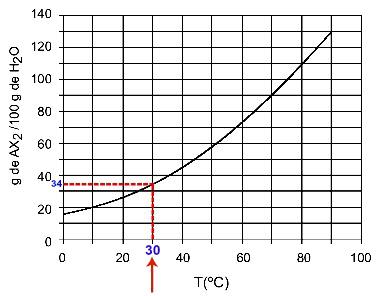
Προσδιορισμός της διαλυτότητας AX2 στις 30ΟΝΤΟ
40ΟΝΤΟ: Όταν ενεργοποιούμε τη θερμοκρασία 40ΟC στην καμπύλη και μετά στην καμπύλη στον άξονα y, έχουμε ότι, σε αυτή τη θερμοκρασία, τα 100 γραμμάρια νερού μπορούν να διαλύσουν περίπου 45 γραμμάρια διαλυμένης ΑΧ2.
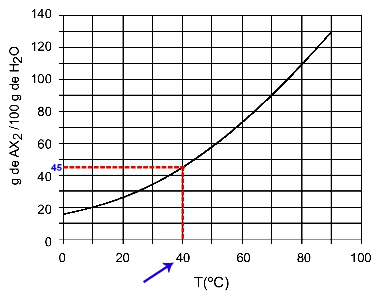
Προσδιορισμός της διαλυτότητας AX2 στα 40ΟΝΤΟ
Καθώς η διαλυμένη ποσότητα διαλυμένης ουσίας είναι μεγαλύτερη με κάθε αύξηση της θερμοκρασίας, έχουμε το AX2 είναι μια ενδοθερμική διαλυμένη ουσία.
γ) ερμηνεία κειμένου
Δείτε το ακόλουθο παράδειγμα:
Παράδειγμα: (PUC-MG) Ορισμένες ουσίες μπορούν να σχηματίσουν ομοιογενή μείγματα με άλλες ουσίες. Η ουσία που είναι στη μεγαλύτερη ποσότητα ονομάζεται διαλύτης και αυτή που είναι στη μικρότερη ποσότητα ονομάζεται διαλυμένη ουσία. Το χλωριούχο νάτριο (NaCl) σχηματίζει ένα ομοιογενές διάλυμα με νερό, στο οποίο είναι δυνατόν να διαλυτοποιηθεί, στους 20 ° C, 36 g NaCl σε 100 g νερού.
Το κείμενο αναφέρει ότι εάν έχουμε 100 γραμμάρια νερού (διαλύτης), σε θερμοκρασία 20 ΟΓ, είναι δυνατόν να διαλυθούν έως και 36 γραμμάρια NaCl.
Από μένα. Diogo Lopes Dias
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm


