Στην καθημερινή ζωή και στα εργαστήρια, υπάρχουν αντιδράσεις και μετασχηματισμοί που είναι αυθόρμητοι και άλλοι που δεν είναι αυθόρμητοι. Για παράδειγμα, όλη η καύση είναι μια αυθόρμητη αντίδραση, γιατί μόλις ξεκινήσει, θα συνεχιστεί έως ότου καταναλωθεί όλο το καύσιμο ή μέχρι να εξαφανιστεί όλο το οξυγόνο.
Από την άλλη πλευρά, η ηλεκτρόλυση είναι μια μη αυθόρμητη διαδικασία, στην οποία η ηλεκτρική ενέργεια μετατρέπεται σε χημική ενέργεια. Ένα παράδειγμα είναι η ηλεκτρόλυση χλωριούχου νατρίου (NaCl). Όταν ένα ηλεκτρικό ρεύμα περνά πάνω από αυτό το λιωμένο άλας, υπάρχουν οξειδοαναγωγικές αντιδράσεις και σχηματισμός μεταλλικού νατρίου (Na(μικρό)) και αέριο χλώριο (Cl2 (ζ)). Εάν σταματήσουμε να τρέχουμε ηλεκτρικό ρεύμα, η αντίδραση δεν θα συνεχιστεί από μόνη της, πράγμα που δείχνει ότι δεν είναι αυθόρμητο.
Ο αυθορμητισμός μιας αντίδρασης μπορεί να μετρηθεί χρησιμοποιώντας το Εξίσωση Gibbs-Helmholtz, δινεται παρακατω:

Σε τι:
ΔG = μεταβολή της ελεύθερης ενέργειας ·
ΔH = αλλαγή ενθαλπίας;
T = θερμοκρασία σε Kelvin (πάντα θετική);
ΔS = αλλαγή εντροπίας.
Αυτή η εξίσωση παίρνει το όνομά της επειδή προτάθηκε από τον Αμερικανό φυσικό J. Ο Willard Gibbs (1839-1903) και ο Γερμανός φυσικός Hermann Helmholtz (1821-1894).
Για να κατανοήσουμε καλύτερα πώς αυτή η εξίσωση μας βοηθά να προσδιορίσουμε τον αυθορμητισμό μιας αντίδρασης, ας εξετάσουμε εν συντομία καθεμία από τις έννοιες που εμπλέκονται σε αυτήν:
- ΔH (παραλλαγή ενθαλπίας): Το Enthalpy (H) είναι το ενεργειακό περιεχόμενο μιας ουσίας. Μέχρι στιγμής, δεν είναι γνωστός τρόπος να προσδιοριστεί. Στην πράξη, αυτό που επιτυγχάνεται είναι η μέτρηση της παραλλαγής ενθαλπίας (ΔΗ) μιας διαδικασίας, χρησιμοποιώντας θερμόμετρα. Αυτή η παραλλαγή είναι το ποσό των ενέργεια που απελευθερώθηκε ή απορροφήθηκε στη διαδικασία.
- ΔS (παραλλαγή εντροπίας):Η εντροπία (S) είναι η θερμοδυναμική ποσότητα που μετρά τον βαθμό διαταραχής σε ένα σύστημα.
Για παράδειγμα, στην τήξη του πάγου, τα μόρια μετακινούνται από στερεά σε υγρή κατάσταση, όπου υπάρχει μεγαλύτερη αποδιοργάνωση. Αυτό σημαίνει ότι σε αυτή τη διαδικασία η εντροπία αυξήθηκε (ΔS> 0).
Στην παραγωγή αμμωνίας (NH3), 1 mol αερίου αζώτου αντιδρά με 3 mol αερίου υδρογόνου (δηλ. 4 mol μορίων στα αντιδραστήρια), δίνοντας 2 mol αμμωνίας:
Ν2 (ζ) +3 Ω2 (ζ) → 2 ΝΗ3 (ζ)
Δεδομένου ότι ο αριθμός των μορίων στη φάση αερίου μειώνεται σε αυτήν τη διαδικασία, η αποδιοργάνωση μειώθηκε, πράγμα που σημαίνει ότι η εντροπία μειώθηκε επίσης (ΔS <0).
- ΔG (Ελεύθερη ενέργεια): Δωρεάν ενέργεια ή Χωρίς ενέργεια Gibbs (επειδή προτάθηκε μόνο από αυτόν τον επιστήμονα το 1878) είναι η χρήσιμη ενέργεια του συστήματος που χρησιμοποιείται για την εργασία.
Ένα σύστημα έχει παγκόσμια ενέργεια, αλλά μόνο ένα κλάσμα αυτής της ενέργειας θα χρησιμοποιηθεί για δουλειά, αυτό ονομάζεται Gibbs free energy, που σολ.
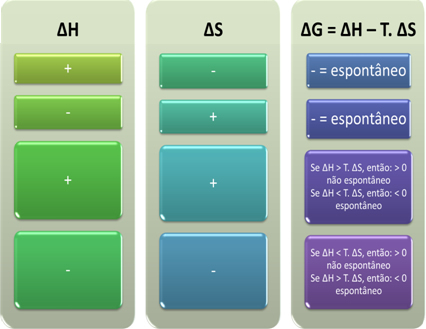
Σύμφωνα με τον Gibbs, μια διαδικασία θεωρείται αυθόρμητη εάν εκτελεί εργασία, δηλαδή εάν το G μειωθεί. Σε αυτήν την περίπτωση, η τελική κατάσταση του μετασχηματισμού θα είναι πιο σταθερή από την αρχική όταν ΔG <0.
Με βάση αυτό, μπορούμε να συμπεράνουμε τα εξής:

Μπορούμε επίσης να δούμε αν μια διαδικασία θα είναι αυθόρμητη κοιτάζοντας το αλγεβρικό σημάδι ΔH και ΔS στην εξίσωση Gibbs-Helmholtz:
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm