Η χωρητικότητα που έχουν οι συνδέσεις για να προσελκύσουν ηλεκτρικά φορτία ορίζεται ως Πολικότητα, η οποία αποκτά διαφορετικό χαρακτήρα ανάλογα με τη σύνδεση όπου υπάρχει.
Οι πιο συνηθισμένοι δεσμοί που περιλαμβάνουν οργανικές ενώσεις συμβαίνουν μεταξύ ατόμων άνθρακα ή μεταξύ ατόμων άνθρακα και υδρογόνου: C ─ C και C hydr H (υδρογονάνθρακες). Ταξινομούμε αυτόν τον τύπο δεσμού ως ομοιοπολικό, υπάρχει σε όλους τους δεσμούς οργανικών ενώσεων που σχηματίζονται μόνο από άνθρακα και υδρογόνο.
Όταν στο μόριο μιας οργανικής ένωσης υπάρχει ένα άλλο χημικό στοιχείο εκτός από τον άνθρακα και το υδρογόνο, τα μόρια της θα έχουν μια ορισμένη πολικότητα. Καλούμε αυτό το στοιχείο ετεροάτομο και μπορεί να είναι: άζωτο (N), οξυγόνο (O), μεταξύ άλλων.
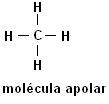
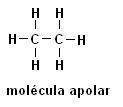
Μεθάνιο (CH4) Αιθάνιο (Γ2Η6)
Σημειώστε ότι και στις δύο δομές δεν υπάρχει παρουσία ετεροάτομων, στην περίπτωση αυτή τα μόρια ταξινομούνται ως μη πολικά.


Η παρουσία οξυγόνου ως ετεροάτομου κάνει τα μόρια να δείχνουν πολικότητα. Το πρώτο μόριο είναι η ένωση Αιθανόλη (
Χ.Χ.3Χ.Χ.2Ω), η παρουσία υδροξυλίου - ΟΗ δίνει σε αυτήν την ένωση έναν πολικό χαρακτήρα, ακόμη και αν στη δομή του περιέχει ένα μη πολικό μέρος.Από τη Lria Alves
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας
Δείτε περισσότερα! επίπεδο ισομερές
Οργανική χημεία - Χημεία - Σχολείο της Βραζιλίας
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm

