Τα οξέα και οι βάσεις είναι δύο τύποι διαβρωτικών ουσιών, αλλά θεωρούνται χημικά αντίθετα.
Μία από τις μεγαλύτερες διαφορές μεταξύ οξέων και βάσεων είναι ότι οι βάσεις, σε επαφή με υδατικό διάλυμα, απελευθερώνουν αρνητικά ιόντα, υδροξύλια (ΟΗ-). Τα οξέα, σε επαφή με το νερό, απελευθερώνουν θετικά ιόντα υδρογόνου (Η+).
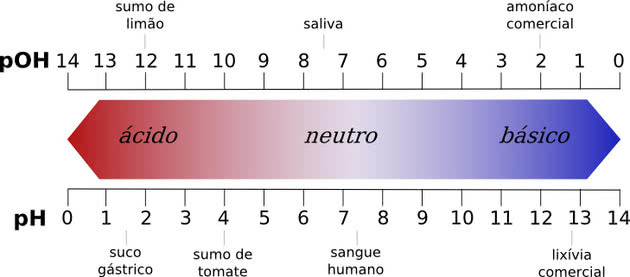
Οποιαδήποτε ουσία με τιμή pH μεταξύ 0 και 7 θεωρείται όξινη, ενώ τιμή pH από 7 έως 14 είναι βάση. Η τιμή 7 είναι ουδέτερη, η οποία αντιστοιχεί στο νερό.
| Οξέα | Βάσεις | |
|---|---|---|
| Ορισμός του Arrhenius | Οξύ είναι οποιαδήποτε χημική ένωση που, σε υδατικό διάλυμα, απελευθερώνει ιόντα υδρογόνου (Η+). |
Μια βάση, ή αλκάλι, είναι μια ουσία που, σε υδατικό διάλυμα, απελευθερώνει υδροξύλια, αρνητικά ιόντα (ΟΗ-) |
| Ορισμός του Bronsted-Lowry | Ένα οξύ είναι μια ουσία που δίνει ένα πρωτόνιο. | Βάση είναι κάθε ουσία που δέχεται ένα πρωτόνιο. |
| ορισμός του λούις | Κατά τη διάρκεια ενός χημικού δεσμού, τα οξέα είναι αυτά που λαμβάνουν ζεύγη ηλεκτρονίων. | Σε έναν χημικό δεσμό, οι βάσεις είναι αυτές που δίνουν ζεύγη ηλεκτρονίων. |
| τιμή pH | Λιγότερο από 7,0. | Μεγαλύτερο από 7,0. |
| Φυσικά χαρακτηριστικά | Τα οξέα μπορεί να υπάρχουν σε στερεή, υγρή ή αέρια μορφή, ανάλογα με τη θερμοκρασία. | Συχνά στερεό εκτός από την αμμωνία που είναι αέριο. |
| Δομή | Τα οξέα είναι μοριακά, δηλαδή σχηματίζονται από ομοιοπολικούς δεσμούς στους οποίους μοιράζονται τα ηλεκτρόνια. | Οι βάσεις μπορεί να είναι ιοντικές ή μοριακές. |
| χημική φόρμουλα | Τα οξέα έχουν χημικό τύπο με Η στην αρχή, για παράδειγμα, HCl (υδροχλωρικό οξύ). Το οξικό οξύ (ξίδι) αποτελεί εξαίρεση, με το CH3COOH. | Οι βάσεις έχουν ΟΗ στο τέλος του τύπου τους, για παράδειγμα NaOH (υδροξείδιο του νατρίου). |
| Διαλυτότητα στο νερό | Τείνουν να είναι αρκετά διαλυτά στο νερό. | Οι περισσότερες βάσεις είναι πρακτικά αδιάλυτες. |
| Αντίδραση στον δείκτη φαινολοφθαλεΐνης | Παραμένει άχρωμο. | Κάντε το διάλυμα ροζ. |
| Ph test (με χαρτί λακκούβας) | Γίνεται κόκκινο. | Γίνεται μπλε. |
| Ηλεκτρική αγωγιμότητα | Αγάγουν ηλεκτρισμό μόνο όταν διαλύονται στο νερό. | Διοχετεύουν επίσης ηλεκτρικό ρεύμα σε υδατικό διάλυμα. |
| Παραδείγματα | Οξεικό οξύ, θειικό οξύ. | Υδροξείδιο του νατρίου, αμμωνία |
Τι είναι τα οξέα και οι βάσεις
Τα οξέα είναι ιοντικές ενώσεις που όταν διαλύονται στο νερό δημιουργούν ένα θετικό ιόν υδρογόνου (Η+). Οι βάσεις, από την άλλη πλευρά, είναι ιοντικές ενώσεις που σχηματίζουν ένα αρνητικά φορτισμένο ιόν υδροξειδίου (ΟΗ-) στο νερό.
Αυτός ο ορισμός, που δημιουργήθηκε από τον Σουηδό επιστήμονα Svante Arrhenius, είναι ο πιο χρησιμοποιούμενος για την ταξινόμηση οξέων και βάσεων, ωστόσο, υπάρχουν και άλλοι ορισμοί.
Ο ορισμός που δόθηκε από τον Johannes N. Ο Bronsted και ο Thomas Lowry, γνωστός ως ο ορισμός του πρωτονίου, λέει ότι τα οξέα είναι ουσίες που δίνουν ένα πρωτόνιο, ενώ οι βάσεις είναι εκείνες που δέχονται ένα πρωτόνιο.
Στον ορισμό που δίνει ο Βορειοαμερικανός Gilbert Newton Lewis, τα οξέα είναι ουσίες που λαμβάνουν ζεύγη ηλεκτρονίων σε έναν χημικό δεσμό, ενώ οι βάσεις δίνουν ζεύγη.
pH οξέων και βάσεων
Όλες οι χημικές ενώσεις έχουν τιμή pH, η οποία μπορεί να κυμαίνεται από 0 έως 14, όπου οι αριθμοί αντιπροσωπεύουν τη συγκέντρωση ιόντων υδρογόνου σε ένα διάλυμα.
Το ουδέτερο pH είναι το pH του καθαρού νερού, το οποίο είναι 7. Οποιαδήποτε ουσία με τιμή pH μεταξύ 0 και 7 θεωρείται όξινη, ενώ τιμή pH από 7 έως 14 είναι βάση.
Όσο χαμηλότερο είναι το οξύ κάτω από 7,0, τόσο ισχυρότερο είναι. Στις βάσεις, όσο υψηλότερη είναι η τιμή του pH, τόσο ισχυρότερο θα είναι.
Χαρακτηριστικά των οξέων:
- Έχει πικρή γεύση.
- Μπορεί να κάψει το δέρμα όταν αγγίζεται.
- Μπορεί να διαβρώσει μέταλλα και δέρμα.
- Κάνει το χαρτί λακκούβας κόκκινο.
- Στον καθολικό δείκτη προσδιορίζεται με κόκκινα ή πορτοκαλί χρώματα.
Χαρακτηριστικά των Βάσεων
- Στυφή γεύση?
- Όταν αγγίζετε, αισθάνεστε κάτι παχύρρευστο.
- Πολλές βάσεις αντιδρούν με οξέα και παράγουν άλατα.
- Οι ισχυρές βάσεις μπορούν να αντιδράσουν βίαια με οξέα.
- Οι βάσεις γίνονται μπλε από χαρτί λακκούβας.
Δείκτες οξέων και βάσεων
Οι δείκτες pH ή οι δείκτες οξέος-βάσης, είναι ουσίες που χρησιμοποιούνται για να διαπιστωθεί εάν ένα διάλυμα είναι οξύ ή βάση.
Αυτό είναι δυνατό λόγω των φυσικοχημικών ιδιοτήτων του, οι οποίες έχουν την ικανότητα να αλλάζουν χρώμα ανάλογα με το pH της υπό δοκιμή ουσίας.
Μεταξύ των πολλών τεχνητών δεικτών που χρησιμοποιούνται στο εργαστήριο, οι πιο γνωστοί είναι η φαινολοφθαλεΐνη, το χαρτί λακκούβας και οι καθολικοί δείκτες.
- Η φαινολοφθαλεΐνη παραμένει άχρωμη σε επαφή με το οξύ και γίνεται ροζ σε επαφή με τις βάσεις.
- Το χαρτί λακκούβας γίνεται μπλε με τις βάσεις και κόκκινο με τα οξέα.
- Ο γενικός δείκτης είναι ο πιο ακριβής από τους δείκτες οξέος-βάσης καθώς δείχνει διαφορετικά χρώματα ανάλογα με κάθε τιμή pH.

Εφαρμογές οξέων και βάσεων στην καθημερινή ζωή
Τα οξέα χρησιμοποιούνται συχνά για την αφαίρεση της σκουριάς από τα μέταλλα, ως ηλεκτρολύτης στις μπαταρίες, για την επεξεργασία ορυκτών, για την παραγωγή λιπασμάτων και βενζίνης και ως πρόσθετα στα τρόφιμα και αναψυκτικά.
Οι βάσεις χρησιμοποιούνται κυρίως στον καθαρισμό, όπως απορρυπαντικά πιάτων και σαπούνι πλυντηρίου, καθαριστικά φούρνου και καθαριστικά λεκέδων.