Ο επιστήμονας Friedrich Kohlrausch (1840-1910) ήταν ο πρώτος που πρότεινε ότι το καθαρό νερό διοχετεύει ηλεκτρισμό, αν και σε μικρή κλίμακα. Αυτό συμβαίνει επειδή το νερό συμπεριφέρεται με αμφοτερικό τρόπο. δηλαδή, σε ορισμένες περιπτώσεις δρα σαν οξύ, δωρίζοντας πρωτόνια (Η+); και σε άλλους συμπεριφέρεται σαν βάση, λαμβάνοντας πρωτόνια.
Αυτό σημαίνει ότι το νερό εκτελεί τον δικό του ιονισμό, σύμφωνα με τη χημική εξίσωση που φαίνεται παρακάτω:
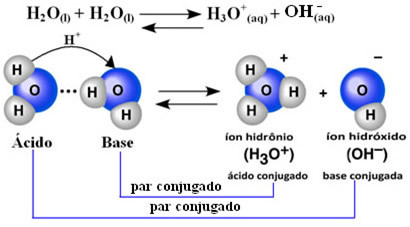
Αυτή η διαδικασία ονομάζεται αυτοματοποίηση νερού και εμφανίζεται σε πολύ μικρή κλίμακα, δηλαδή, το νερό είναι ένας πολύ ασθενής ηλεκτρολύτης, με χαμηλές τιμές βαθμού ιονισμού και σταθεράς ιονισμού σε ισορροπία (Κντο). Γι 'αυτό ακριβώς το νερό έχει τόσο χαμηλή αγωγιμότητα.
Για να πάρετε μια ιδέα, σε θερμοκρασία περιβάλλοντος 25 ° C είναι δυνατόν να προσδιορίσετε ότι οι συγκεντρώσεις ιόντων υδροξειδίου και υδρονίου που παράγονται στον αυτο-ιονισμό καθαρού νερού είναι ίσες με 1. 10-7 mol. μεγάλο-1. Αυτό σημαίνει ότι από ένα δισεκατομμύριο μόρια νερού, μόνο δύο ιοντίζονται.
Η σταθερά ιοντικής ισορροπίας του νερού ονομάζεται ντοσταθερά διαχωρισμού νερού,σταθερά αυτόματης ανάλυσηςή ιοντικό προϊόν νερού.Αυτή η σταθερά αντιπροσωπεύεται από κβ, επειδή το w αναφέρεται στη λέξη νερό, που στα Αγγλικά σημαίνει νερό.
Ο υπολογισμός του γίνεται με τον ίδιο τρόπο όπως οι άλλες σταθερές ισορροπίας, θυμόμαστε ότι, όπως αναφέρεται στο κείμενο "Σταθερές του Υπόλοιπο Kc και Kp », στην περίπτωση αυτή, μόνο τα προϊόντα θα εμφανίζονται στην έκφραση, επειδή το νερό σε υγρή κατάσταση έχει την ίδια δραστηριότητα έως 1. Οι καθαρές υγρές ή στερεές ουσίες δεν τίθενται στη σταθερή έκφραση του διαχωρισμού επειδή δεν αλλάζουν. Τοποθετούνται μόνο υδατικά και αέρια διαλύματα. Έτσι έχουμε:
κβ = [Η3Ο+]. [ω-]
κβ = (1. 10-7). (1. 10-7)
κβ = 10-14
Όπως και με τις άλλες σταθερές ισορροπίας, Εντάξειβ αλλάζει μόνο με την αλλαγή της θερμοκρασίας. Καθώς αυξάνεται η θερμοκρασία του νερού, αυξάνεται επίσης ο ιονισμός του, πράγμα που σημαίνει ότι ο αυτο-ιονισμός του νερού είναι μια ενδοθερμική διαδικασία, δηλαδή απορροφά θερμότητα.
Αυτό φαίνεται στις τιμές του ιοντικού προϊόντος του νερού (Κβ) δίνεται στον παρακάτω πίνακα σε διαφορετικές θερμοκρασίες:
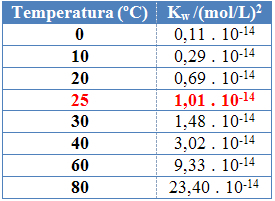
Το ιοντικό προϊόν του νερού θα έχει πάντα μια σταθερή τιμή σε κάθε θερμοκρασία, είτε σε καθαρό νερό είτε σε διάλυμα. Ακόμα κι αν το διάλυμα έχει συγκεντρώσεις ιόντων Η3Ο+ και ω- διαφορετικά, το προϊόν μεταξύ τους θα παραμείνει σταθερό.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
