Η ηλεκτρονική κατανομή αναφέρεται στον τρόπο με τον οποίο τα ηλεκτρόνια κατανέμονται στα στρώματα ή στα επίπεδα ενέργειας που περιβάλλουν τον πυρήνα του ατόμου.
Σύμφωνα με το ατομικό μοντέλο Rutherford-Böhr, τα άτομα των γνωστών χημικών στοιχείων έχουν το πολύ επτά ηλεκτρονικά στρώματα, τα οποία αυξάνουν την ενέργεια από το εσωτερικό προς το εξωτερικό του πυρήνα (1 – 2 – 3 – 4 – 5 – 6 – 7). Αυτά τα επτά στρώματα μπορούν επίσης να χαρακτηριστούν με τα αντίστοιχα γράμματα K – L – M – N – O – P – Q, με το K να είναι το πρώτο, να είναι πιο κοντά στον πυρήνα και να έχει τη χαμηλότερη ενέργεια. Από την άλλη πλευρά, το στρώμα Q είναι το έβδομο, όντας το πιο απομακρυσμένο από τον πυρήνα και αυτό με την υψηλότερη ενέργεια.
Δεδομένου ότι κάθε άτομο έχει έναν ατομικό αριθμό (ποσότητα πρωτονίων στον πυρήνα) και διαφορετικό αριθμό ηλεκτρονίων, το Τα ηλεκτρονιακά στρώματα κάθε ατόμου έχουν διαφορετικές ενέργειες που συγκρατούν ηλεκτρόνια με αυτήν την ενέργεια προσδιορίζεται.
Mind Map: Ηλεκτρονική Διανομή

* Για να κατεβάσετε τον χάρτη μυαλού σε PDF, Κάντε κλικ ΕΔΩ!
Σημειώστε παρακάτω μερικά άτομα και ηλεκτρόνια που κατανέμονται στα ηλεκτρονικά τους στρώματα:

Άτομο υδρογόνου, ηλίου, βηρυλλίου και οξυγόνου
Σημειώστε ότι η κατανομή των τεσσάρων ατόμων του βηρυλλίου είναι: 2 – 2, και αυτή του οξυγόνου είναι 2 – 6. Μόνο μέσα από αυτά τα παραδείγματα είναι δυνατό να διαπιστωθεί ότι η ηλεκτρονική διανομή ακολουθεί μια παραγγελία. Για παράδειγμα, το κέλυφος Κ (1) μπορεί να έχει το πολύ δύο ηλεκτρόνια.
Παρακάτω έχουμε έναν πίνακα που καθορίζει τη μέγιστη ποσότητα ηλεκτρονίων που μπορεί να κατανεμηθεί σε κάθε ηλεκτρονικό στρώμα:
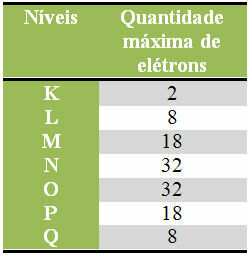
Μέγιστος αριθμός ηλεκτρονίων σε ηλεκτρονικά επίπεδα
Θα πρέπει επίσης να θυμόμαστε ότι το τελευταίο κέλυφος που θα γεμίσει, το λεγόμενο κέλυφος σθένους, πρέπει να έχει το πολύ οκτώ ηλεκτρόνια. Αν λοιπόν κατανείματε τα ηλεκτρόνια και δείτε ότι το τελευταίο κέλυφος είχε ποσότητα μεγαλύτερη από 8, αλλά μικρότερη ότι το 18, λοιπόν, θα πρέπει να αφήσει μόνο 8 ηλεκτρόνια σε αυτό το φλοιό και να προσθέσει τα υπόλοιπα στον επόμενο φλοιό συν εξωτερικός.
Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)
Για παράδειγμα, εξετάστε την ηλεκτρονική κατανομή του ατόμου ασβεστίου. Κοιτάζοντας τον περιοδικό πίνακα, βλέπουμε ότι έχει ατομικό αριθμό ίσο με 20, ενώ, στη θεμελιώδη κατάσταση, υπάρχει ο ίδιος αριθμός ηλεκτρονίων. Άρα, πρέπει να κατανείμουμε 20 ηλεκτρόνια στα ηλεκτρονιακά τους κελύφη. Δείτε το παρακάτω:
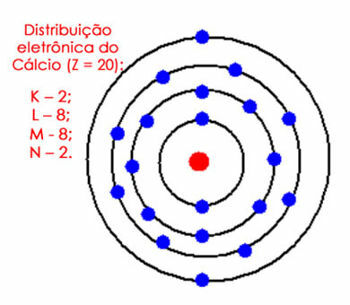
Ηλεκτρονική κατανομή του ασβεστίου στο άτομο
Σημειώστε ότι το φλοιό M μπορεί να χωρέσει έως και 18 ηλεκτρόνια, αλλά αν βάλουμε τα υπόλοιπα ηλεκτρόνια σε αυτό, θα είχε 10 ηλεκτρόνια, κάτι που δεν μπορεί να συμβεί στο φλοιό σθένους. Βάζουμε λοιπόν τα άλλα ηλεκτρόνια (2) στο επόμενο φλοιό, που είναι το Ν.
Αλλά αν η ποσότητα των ηλεκτρονίων στο τελευταίο κέλυφος είναι μεταξύ 18 και 32, αφήνετε 18 ηλεκτρόνια και περνάτε τα υπόλοιπα στα εξωτερικά κελύφη. Δείτε ένα άλλο παράδειγμα:
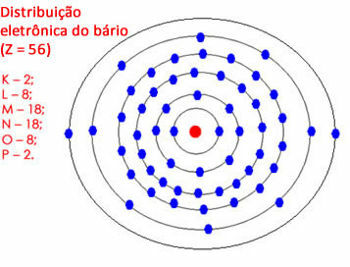
Ηλεκτρονική κατανομή βαρίου στο άτομο
Σημειώστε ότι το κέλυφος "N" μπορεί να περιέχει το πολύ 32 ηλεκτρόνια, αλλά εδώ θα έχει 28. Αφήνουμε λοιπόν 18 ηλεκτρόνια και περνάμε τα υπόλοιπα στο επόμενο κέλυφος. Αλλά το φλοιό "O" θα είχε 10 ηλεκτρόνια, οπότε αφήσαμε 8 και κατανείμαμε τα άλλα 2 ηλεκτρόνια που είχαν απομείνει στο φλοιό "P".
Ωστόσο, υπάρχει ένας ευκολότερος τρόπος για να πραγματοποιηθεί αυτή η ηλεκτρονική κατανομή των ηλεκτρονίων ενός ατόμου. Είναι μέσω του Διάγραμμα Pauling (αφού δημιουργήθηκε από τον επιστήμονα Linus Carl Pauling (1901-1994)), γνωστό και ως ηλεκτρονικό διάγραμμα διανομής ή ακόμα, Διάγραμμα επιπέδων ενέργειας. Αυτό το διάγραμμα μοιάζει με αυτό:
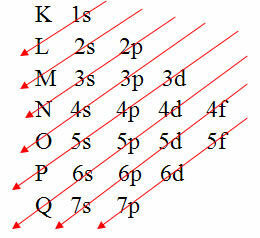
Η γραφική αναπαράσταση της ηλεκτρονικής διανομής δίνεται από το διάγραμμα Pauling
Για να κατανοήσετε πώς γίνονται οι ηλεκτρονικές κατανομές ηλεκτρονίων και ιόντων σε αυτό το διάγραμμα, διαβάστε τα παρακάτω κείμενα:
* κατανομή ηλεκτρονίων;
* ηλεκτρονική διανομή ιόντων.
* Πιστωτική εικόνα από τον Linus Pauling: Nobelprize.org
** Mind Map by Me. Diogo Lopes
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε ένα σχολικό ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Τι είναι η ηλεκτρονική διανομή;" Σχολή Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-distribuicao-eletronica.htm. Πρόσβαση στις 27 Ιουλίου 2021.
Χημεία

Niels Bohr, άτομο του Bohr, ατομική φυσική, σταθερό άτομο, ατομικό μοντέλο, πλανητικό σύστημα, στρώματα της ηλεκτροσφαίρας, επίπεδα ενέργειας, κελύφη ηλεκτρονίων, ενέργεια ηλεκτρονίων, ατομικό μοντέλο Rutherford, άτομο διεγερμένης κατάστασης.
