Kp είναι το αρκτικόλεξο που χρησιμοποιείται για τον προσδιορισμό του σταθερά μιας ισορροπίας όσον αφορά τις μερικές πιέσεις. Αυτή η σταθερά λειτουργεί με τις τιμές των αερίων συμμετεχόντων μιας ισορροπίας στη μονάδα atm, για παράδειγμα.

Εξίσωση που αντιπροσωπεύει μια χημική αντίδραση με αέρια συστατικά
Σε αυτή την εξίσωση, όλοι οι συμμετέχοντες είναι αέριοι, οπότε όταν ένα συμμετέχον αέριο έχει α μερική πίεση στο μείγμα, αντιπροσωπεύεται από τη συντομογραφία pX.
Κατά τη ρύθμιση της εξίσωσης χημικής ισορροπίας (από άποψη συγκέντρωσης), τα προϊόντα πρέπει να τοποθετούνται στον αριθμητή και τα αντιδρώντα στον παρονομαστή:
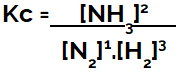
Έκφραση Kc ισορροπίας σχηματισμού αμμωνίας
η έκφραση του σταθερά ισορροπίας ως προς την πίεση (Kp) ακολουθεί το πρότυπο του Kc, δηλαδή, οι μερικές πιέσεις των αντιδραστηρίων τοποθετούνται στον παρονομαστή και οι μερικές πιέσεις των προϊόντων στον αριθμητή:
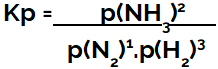
Έκφραση Kp ισορροπίας σχηματισμού αμμωνίας
Παρατήρηση: Αν η εξίσωση αντίδρασης του χημική ισορροπία μην παρουσιάσετε κανένα αέριο συμμετέχοντα, δεν θα παρουσιαστεί αυτόματα Kp.
Παράδειγμα: (PUC-MG) Για την αντίδραση: 2 CO(σολ) + Ο2 (g)? 2 CO2 (g), οι μερικές πιέσεις του CO(σολ) είναι το2 (g) στην ισορροπία είναι, αντίστοιχα, 0,2 atm και 0,4 atm. Η συνολική πίεση του συστήματος είναι 1,4 atm. Η αξία του Kp για την αντίδραση είναι:
α) 56.2
β) 40,0
γ) 35,6
δ) 28.4
ε) 25.6
Τα στοιχεία που παρέχονται από την άσκηση είναι:
Μερική πίεση μονοξειδίου του άνθρακα (pCO) = 0,2 atm;
Μερική πίεση μονοξειδίου του άνθρακα (pO2) = 0,4 atm;
Ολική πίεση =1,4 atm;
Για να προσδιορίσουμε το Kp αυτού του συστήματος, πρέπει να εκτελέσουμε τα ακόλουθα βήματα:
1ο Βήμα: Προσδιορίστε τη μερική πίεση του μονοξειδίου του άνθρακα (pCO2).
Για αυτό, απλώς θυμηθείτε ότι η ολική πίεση (pt) είναι το άθροισμα όλων των μερικών πιέσεων:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2ο Βήμα: Προσδιορίστε το Kp της άσκησης.
Για αυτό, απλώς χρησιμοποιήστε τις τιμές στην έκφραση της σταθεράς ισορροπίας Kp:
Kp = (pCO2)2
(pCO)2.(σκόνη2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Από εμένα Diogo Lopes Dias
Πηγή: Σχολείο Βραζιλίας - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm


