Η χημική κινητική μελετά την ταχύτητα των χημικών αντιδράσεων και τους παράγοντες που επηρεάζουν το ρυθμό αυτών των αντιδράσεων.
Χρησιμοποιήστε τις παρακάτω ερωτήσεις για να ελέγξετε τις γνώσεις σας και να δείτε τα σχόλια σχετικά με τα ψηφίσματα.
ερώτηση 1
Όσον αφορά τους παράγοντες που επηρεάζουν την ταχύτητα μιας χημικής αντίδρασης, είναι ΛΑΘΟΣ να δηλώνουμε ότι:
α) Όσο υψηλότερη είναι η συγκέντρωση των αντιδρώντων, τόσο ταχύτερη είναι η αντίδραση.
β) Όσο μεγαλύτερη είναι η επιφάνεια επαφής, τόσο μεγαλύτερη είναι η ταχύτητα αντίδρασης.
γ) Όσο υψηλότερη είναι η πίεση, τόσο πιο γρήγορη είναι η αντίδραση.
δ) Όσο υψηλότερη είναι η θερμοκρασία, τόσο πιο γρήγορη είναι η αντίδραση.
ε) Η παρουσία καταλύτη διατηρεί σταθερό τον ρυθμό αντίδρασης.
Λανθασμένη εναλλακτική λύση: ε) Η παρουσία καταλύτη διατηρεί τον ρυθμό αντίδρασης σταθερό.
Οι καταλύτες αυξάνουν την ταχύτητα αντίδρασης, καθώς διευκολύνουν το σχηματισμό του ενεργοποιημένου συμπλόκου μεταξύ των αντιδρώντων.
Με αυτό, οι καταλύτες δημιουργούν έναν μικρότερο μηχανισμό για την ανάπτυξη της αντίδρασης, προκαλώντας την αύξηση της ταχύτητας.
Ερώτηση 2
Σύμφωνα με _____________ πρέπει να συμβούν αποτελεσματικές συγκρούσεις μεταξύ των αντιδραστηρίων για το σχηματισμό των προϊόντων. Επιπλέον, υπάρχει αρκετό ___________ για να σπάσει τους χημικούς δεσμούς των αντιδρώντων και να σχηματίσει ένα ___________, το οποίο είναι μια ενδιάμεση κατάσταση πριν από το σχηματισμό προϊόντων.
Οι λέξεις που συμπληρώνουν σωστά τα κενά είναι, αντίστοιχα:
α) παραλλαγή ενθαλπίας, κινητικής ενέργειας και καταλύτη.
β) θεωρία σύγκρουσης, ενέργεια ενεργοποίησης και ενεργοποιημένο σύμπλεγμα.
γ) ταχύτητα αντίδρασης, ενθαλπία και αναστολέας.
δ) μερική πίεση, εντροπία και υπόστρωμα.
Σωστή εναλλακτική λύση: β) θεωρία σύγκρουσης, ενέργεια ενεργοποίησης και ενεργοποιημένο σύμπλεγμα.
Σύμφωνα με τη θεωρία σύγκρουσης, οι συγκρούσεις μεταξύ των αντιδραστηρίων είναι απαραίτητες για να συμβεί μια χημική αντίδραση. Για αυτό, οι ουσίες πρέπει να είναι σε ευνοϊκή θέση για να είναι αποτελεσματικά τα σοκ.
Η ενέργεια ενεργοποίησης ενεργεί ως ενεργειακό φράγμα που πρέπει να ξεπεραστεί για να σπάσει τους δεσμούς των αντιδρώντων ενώσεων. Όσο χαμηλότερη είναι η ενέργεια ενεργοποίησης, τόσο πιο γρήγορη είναι η αντίδραση.
Το ενεργοποιημένο σύμπλοκο είναι ένα ασταθές ενδιάμεσο είδος που σχηματίζεται πριν από τα προϊόντα.
ερώτηση 3
Γίνονται οι ακόλουθες τέσσερις δηλώσεις σχετικά με τους καταλύτες:
ΕΓΩ. Ένας καταλύτης λειτουργεί αυξάνοντας την ταχύτητα μιας αντίδρασης, αλλά δεν αλλάζει την απόδοσή της.
ΙΙ. Σε μια χημική αντίδραση ο καταλύτης δεν καταναλώνεται στη διαδρομή αντίδρασης.
III. Οι καταλύτες δημιουργούν μια εναλλακτική οδό για τη μετατροπή των αντιδραστηρίων σε προϊόντα. Για αυτό, απαιτείται μεγαλύτερη ενέργεια ενεργοποίησης.
IV. Ο καταλύτης είναι σε θέση να επιταχύνει την αντίδραση μόνο προς τα εμπρός.
Οι επιλογές που παρουσιάζουν σωστές πληροφορίες σχετικά με τους καταλύτες είναι:
α) I και II
β) II και III
γ) I και IV
δ) Όλα
Σωστή εναλλακτική λύση: α) I και II.
Οι καταλύτες χρησιμοποιούνται για να επιταχύνουν τις χημικές αντιδράσεις. Η αντίδραση που χρησιμοποιεί τον καταλύτη δεν αλλάζει την απόδοση του, δηλαδή παράγεται η αναμενόμενη ποσότητα του προϊόντος, αλλά σε λιγότερο χρόνο.
Οι καταλύτες δεν καταναλώνονται κατά τη διάρκεια της χημικής αντίδρασης, βοηθούν στο σχηματισμό του ενεργοποιημένου συμπλόκου. Επομένως, ένας καταλύτης μπορεί να ανακτηθεί στο τέλος της χημικής αντίδρασης.
Οι καταλύτες μπορούν να μειώσουν το χρόνο αντίδρασης δημιουργώντας έναν εναλλακτικό μηχανισμό για το σχηματισμό προϊόντων με χαμηλότερη ενέργεια ενεργοποίησης. Επομένως, η αντίδραση εμφανίζεται ταχύτερα.
Οι καταλύτες δρουν τόσο προς τα εμπρός όσο και προς την αντίστροφη κατεύθυνση της αντίδρασης.
ερώτηση 4
Το πόσο γρήγορα λαμβάνει χώρα μια χημική αντίδραση εξαρτάται από:
ΕΓΩ. Αριθμός αποτελεσματικών συγκρούσεων μεταξύ αντιδραστηρίων.
ΙΙ. Αρκετή ενέργεια για την αναδιάταξη των ατόμων.
III. Ευνοϊκός προσανατολισμός των μορίων.
IV. Σχηματισμός ενεργοποιημένου συμπλόκου.
α) I και II
β) II και IV
γ) I, II και III
δ) I, II, III και IV
Σωστή εναλλακτική λύση: δ) I, II, III και IV.
Αποτελεσματικές συγκρούσεις συμβαίνουν όταν τα αντιδραστήρια βρίσκονται σε ευνοϊκές θέσεις για σοκ, γεγονός που θα προάγει την αναδιάταξη των ατόμων.
Η ενέργεια ενεργοποίησης πρέπει να είναι επαρκής ώστε η σύγκρουση μεταξύ των αντιδραστηρίων να έχει ως αποτέλεσμα τη διάσπαση των δεσμών και το σχηματισμό του ενεργοποιημένου συμπλόκου.
Δεν προκαλούν όλες τις συγκρούσεις μεταξύ των αντιδρώντων σωματιδίων την αντίδραση. Ο προσανατολισμός με τον οποίο συμβαίνει η σύγκρουση είναι σημαντικός για τον σχηματισμό των προϊόντων.
Το ενεργοποιημένο σύμπλοκο είναι μια ενδιάμεση και ασταθής κατάσταση πριν από το σχηματισμό προϊόντων. Δημιουργείται όταν ξεπεραστεί η ενέργεια ενεργοποίησης για την αντίδραση.
ερώτηση 5
Το διοξείδιο του άνθρακα είναι ένα αέριο που σχηματίζεται από την αντίδραση μεταξύ μονοξειδίου του άνθρακα και αερίων οξυγόνου, σύμφωνα με την παρακάτω χημική εξίσωση.
CO(σολ) + ½ το2 (ζ) → CO2 (ζ)
Γνωρίζοντας ότι σε 5 λεπτά αντίδρασης καταναλώθηκαν 2,5 mol CO, ποιος είναι ο ρυθμός ανάπτυξης της αντίδρασης σύμφωνα με την κατανάλωση Ο2?
α) 0,2 mol. ελάχ-1
β) 1,5 mol. ελάχ-1
γ) 2,0 mol. ελάχ-1
δ) 0,25 mol. ελάχ-1
Σωστή εναλλακτική λύση: d) 0,25 mol. ελάχ-1
Για να απαντήσουμε σε αυτήν την ερώτηση πρέπει να εξετάσουμε τη χημική εξίσωση.
CO(σολ) + ½ το2 (ζ) → CO2 (ζ)
Σημειώστε ότι 1 γραμμομόριο μονοξειδίου του άνθρακα αντιδρά με ½ γραμμομόριο οξυγόνου σχηματίζοντας 1 γραμμάριο διοξειδίου του άνθρακα.
Η ποσότητα που αναφέρεται στη δήλωση αναφέρεται στο μονοξείδιο του άνθρακα, αλλά η απάντηση πρέπει να είναι όσον αφορά το οξυγόνο. Για αυτό πρέπει να εκτελέσουμε έναν κανόνα τριών και να βρούμε την ποσότητα οξυγόνου.
1 mol CO - ½ mol O2
2,5 mol CO - x του O2
x = 1,25 mol
Τώρα εφαρμόζουμε τις τιμές στον τύπο για τον ρυθμό ανάπτυξης της αντίδρασης.
Επομένως, ο ρυθμός ανάπτυξης της αντίδρασης σε σχέση με το οξυγόνο είναι 0,25 mol.min-1.
ερώτηση 6
Σημειώστε τη γραφική αναπαράσταση της ανάπτυξης μιας υποθετικής χημικής αντίδρασης, η οποία σχετίζεται με την πορεία της ενέργειας και της αντίδρασης.
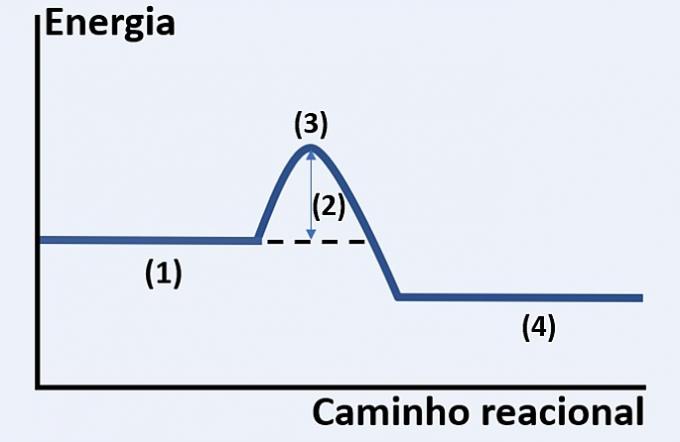
Ελέγξτε την εναλλακτική που αντικαθιστά σωστά τα (1), (2), (3) και (4), αντίστοιχα.
α) υποστρώματα, απελευθερούμενη θερμότητα, μέγιστη ενεργειακή κατάσταση και τέλος αντίδρασης.
β) αντιδραστήρια, ενέργεια ενεργοποίησης, ενεργοποιημένο σύμπλεγμα και προϊόντα.
γ) αντιδραστήρια, κινητική ενέργεια, καταλύτης και υποστρώματα.
δ) αντιδραστήρια, απορροφούμενη θερμότητα, θερμική ενέργεια και προϊόντα.
Σωστή εναλλακτική λύση: β) αντιδραστήρια, ενέργεια ενεργοποίησης, ενεργοποιημένο σύμπλεγμα και προϊόντα.
Το γράφημα που παρουσιάζεται είναι ενδοθερμικής αντίδρασης, δηλαδή υπάρχει απορρόφηση ενέργειας για να συμβεί η αντίδραση.
Εσείς αντιδραστήρια (1) βρίσκονται στην αρχή του γραφήματος και του ενέργεια ενεργοποίησης (2) αντιστοιχεί στη διαφορά μεταξύ της ενέργειας που αποθηκεύεται στα αντιδραστήρια και της ενεργοποιήθηκε το σύμπλεγμα (3). Τέλος, αφού περάσει η ενδιάμεση κατάσταση, ο σχηματισμός του προϊόντα (4).
Επομένως, τα αντιδραστήρια πρέπει να ξεπεράσουν την ενέργεια ενεργοποίησης για να αναδιατάξουν τα άτομα τους σε μια ενδιάμεση δομή που ονομάζεται ενεργοποιημένο σύμπλοκο προκειμένου να σχηματιστούν τα προϊόντα.
ερώτηση 7
Η ουσία Α μπορεί να αποσυνθέσει και να γίνει ουσία Β. Παρατηρήστε την εξέλιξη αυτής της αντίδρασης στην παρακάτω εικόνα.

Όσον αφορά την ταχύτητα αντίδρασης, μπορούμε να πούμε ότι:
α) Ουσία Α αποσυντίθεται μεταξύ 0 και 15 s με ρυθμό 0,35 mols-1.
β) Ουσία Α αποσυντίθεται μεταξύ 15 και 30 s με ρυθμό 0,02 mols-1.
γ) Ουσία Α αποσυντίθεται μεταξύ 0 και 15 s με ρυθμό 0,04 mols-1.
δ) Ουσία Α αποσυντίθεται μεταξύ 15 και 30 s με ρυθμό 0,03 mols-1.
Σωστή εναλλακτική λύση: d) Η ουσία Α αποσυντίθεται μεταξύ 15 και 30 δευτερολέπτων με ρυθμό 0,03 mol.s-1.
Ο ρυθμός αποσύνθεσης της ουσίας Α μπορεί να υπολογιστεί με τον τύπο:
Ας υπολογίσουμε την ταχύτητα της αντίδρασης ως προς την ουσία Α μεταξύ των δεδομένων διαστημάτων.
Εύρος μεταξύ 0 και 15:
Εύρος μεταξύ 15 και 30:
Επομένως, η εναλλακτική d είναι σωστή, καθώς η ουσία Α αποσυντίθεται μεταξύ 15 και 30 s με ρυθμό 0,03 mol.s.-1.
ερώτηση 8
Εξετάστε την ακόλουθη υποθετική αντίδραση.
aA + bB → cC + dD
Σημειώστε τη διακύμανση της συγκέντρωσης Α και Γ παρακάτω.
| Φορές) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Κατανάλωση Α (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Σχηματισμός C (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Με βάση τις πληροφορίες που παρέχονται στην ερώτηση, ποιος είναι, αντίστοιχα, ο ρυθμός κατανάλωσης του Α και ο ρυθμός σχηματισμού του C στο διάστημα μεταξύ 5 και 25 λεπτών;
α) 0,3 mol. μεγάλο-1.μικρό-1 και 0,1 mol. μεγάλο-1.μικρό-1
β) - 0,1 mol. μεγάλο-1.μικρό-1 και 0,3 mol. μεγάλο-1.μικρό-1
c) - 0,25 mol. μεγάλο-1.μικρό-1 και 0,1 mol. μεγάλο-1.μικρό-1
δ) 0,1 mol. μεγάλο-1.μικρό-1 και 0,3 mol. μεγάλο-1.μικρό-1
Σωστή εναλλακτική λύση: c) - 0,25 mol. μεγάλο-1.μικρό-1 και 0,1 mol. μεγάλο-1.μικρό-1.
Ποσοστό κατανάλωσης:
Ποσοστό εκπαίδευσης Γ:
Συνεπώς, στην αντίδραση, το Α καταναλώνεται με ρυθμό 0,25 mol.s-1, οπότε η τιμή του είναι αρνητική, ενώ το Β σχηματίζεται με ρυθμό 0,1 mol. μεγάλο-1.μικρό-1.
Διαβάστε επίσης:
- Χημική Κινητική
- θερμοχημεία
- Χημική ισορροπία
- Χημικές αντιδράσεις


