Οι υδρογονάνθρακες είναι ενώσεις που σχηματίζονται μόνο από άνθρακα και υδρογόνο, με γενικό τύπο: CΧΗγ.
Είναι μια εκτεταμένη ποσότητα ουσιών, οι πιο γνωστές από τις οποίες είναι συστατικά του πετρελαίου και του φυσικού αερίου.
Η ραχοκοκαλιά ενός υδρογονάνθρακα αποτελείται από άνθρακα και, με τη σειρά του, τα άτομα υδρογόνου συνδέονται μέσω ενός ομοιοπολικού δεσμού.
Χρησιμοποιούνται ευρέως στη χημική βιομηχανία, καθώς είναι απαραίτητα για την παραγωγή παραγώγων πετρελαίου: καύσιμα, πολυμερή, παραφίνες, μεταξύ άλλων.
Ιδιότητες υδρογονανθράκων
| μοριακή αλληλεπίδραση | Είναι πρακτικά μη-πολικές ενώσεις και τα μόρια τους ενώνονται από ένα διεγερμένο δίπολο. |
|---|---|
| Σημείο τήξεως και βρασμού | Είναι χαμηλές σε σύγκριση με τις πολικές ενώσεις. |
| καταστάσεις συνάθροισης |
|
| Πυκνότητα | Έχουν χαμηλότερη πυκνότητα από το νερό. |
| Διαλυτότητα | Είναι αδιάλυτα στο νερό και διαλυτά σε μη πολικές ουσίες. |
| Αντιδραστικότητα |
|
Ταξινόμηση υδρογονανθράκων
Όσον αφορά τη μορφή της κύριας αλυσίδας άνθρακα, οι υδρογονάνθρακες ταξινομούνται σε:
αλειφατικοί υδρογονάνθρακες
Σχηματίζεται από ανοικτές ή κυκλικές αλυσίδες άνθρακα, οι οποίες έχουν τερματικούς άνθρακες.
- αλκάνια
- αλκένια
- Αλκίνες
- Αλκαδιένους
Παράδειγμα:
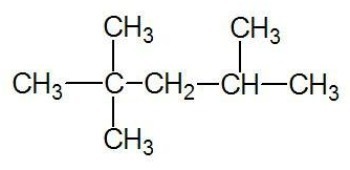
Δείτε επίσης: αλυσίδες άνθρακα
Κυκλικοί υδρογονάνθρακες
Σχηματίζεται από κλειστές ή κυκλικές αλυσίδες άνθρακα που δεν έχουν τερματικούς άνθρακες.
- Κυκλάνοι
- Κύκλοι
- ποδηλάτες
- Αρωματικά
Παραδείγματα:
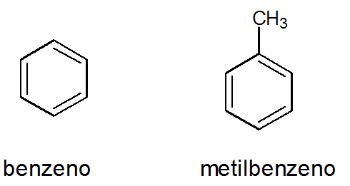
Δείτε επίσης: βενζόλιο
Όσο για τους δεσμούς των αλυσίδων άνθρακα, είτε μονό, διπλό είτε τριπλό:
Κορεσμένοι υδρογονάνθρακες
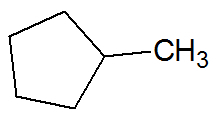
Οι ενώσεις σχηματίζονται από απλούς δεσμούς μεταξύ ατόμων άνθρακα και υδρογόνου.
- αλκάνια
- Κυκλάνοι
Παράδειγμα:
ακόρεστοι υδρογονάνθρακες
Οι ενώσεις που σχηματίζονται έχουν διπλούς ή τριπλούς δεσμούς μεταξύ ατόμων άνθρακα και υδρογόνου.
- αλκένια
- Αλκίνες
- Αλκαδιένους
- Κύκλοι
- ποδηλάτες
- Αρωματικά
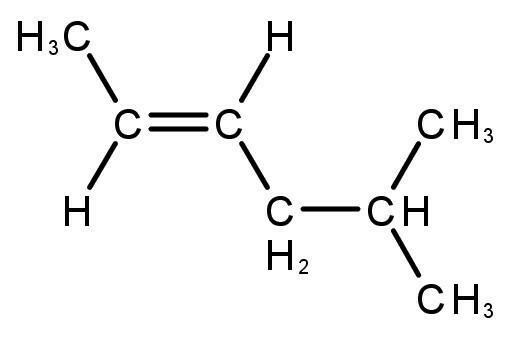
Διαβάστε επίσης:
- Χημικοί δεσμοί
- Οργανική χημεία
- Οργανικές λειτουργίες
Ονοματολογία
Η ονοματολογία των υδρογονανθράκων ορίζεται από τους ακόλουθους όρους:
| ΠΡΟΘΕΜΑ | ΜΕΣΟΛΑΒΗΤΗΣ | ΚΑΤΑΛΗΞΗ |
|---|---|---|
| Υποδεικνύει τον αριθμό των ανθράκων που υπάρχουν στην αλυσίδα. | Τύπος συνδέσμου που βρέθηκε στη συμβολοσειρά. | Προσδιορισμός της λειτουργικής ομάδας. |
| ΠΡΟΘΕΜΑ | ΜΕΣΟΛΑΒΗΤΗΣ | ΚΑΤΑΛΗΞΗ | ||
|---|---|---|---|---|
| 1C | ΣΥΝΑΝΤΗΣΕ | Μόνο ένας σύνδεσμος | ΕΝΑ | Ο |
| 2C | ΕΤ | |||
| 3C | ΣΤΗΡΙΓΜΑ | διπλός δεσμός | ΕΝ | |
| 4C | ΑΛΛΑ | |||
| 5C | ΕΓΚΛΕΙΣΤΟΣ | δύο διπλούς δεσμούς | DIEN | |
| 6Γ | ΜΑΓΕΥΩ | |||
| 7C | ΕΡΤ | τριπλή σύνδεση | ΣΕ |
|
| 8Γ | ΥΧΕ | |||
| 9C | ΜΗ | Δύο τριπλοί σύνδεσμοι | ΔΕΙΝ | |
| 10C | ΔΕΚ |
Παραδείγματα
Ακολουθήστε πώς σχηματίζονται τα ονόματα υδρογονανθράκων:
| Αιθάνιο |
- Πρόθεμα: ΕΤ, που αντιστοιχεί σε 2 άνθρακες.
- Μεσολαβητής: ΕΝΑ, που αντιστοιχεί σε μεμονωμένους συνδέσμους.
- Κατάληξη: Ο, που αντιστοιχεί στη συνάρτηση υδρογονανθράκων.
Κοιτάξτε τα άλλα παραδείγματα:
| Προπάνιο | |
| Αιθίνη | |
| Etino | |
| προπαδιένιο |
Σε ορισμένες περιπτώσεις είναι απαραίτητο να αναφερθεί η θέση του διπλού ή τριπλού δεσμού. Η αρίθμηση πρέπει να ξεκινά από το πλησιέστερο άκρο αυτού του συνδέσμου.
| 1,3-βουταδιένιο | |
| 1-βουτύνιο |
Μάθετε περισσότερα στο:
- Βουτάνιο
- Μεθάνιο
Τύποι υδρογονανθράκων
Ελέγξτε τους κύριους τύπους υδρογονανθράκων, τα χαρακτηριστικά τους και τις ενώσεις που χρησιμοποιούνται:
αλκάνια
Πρόκειται για υδρογονάνθρακες ανοιχτής αλυσίδας με απλούς δεσμούς μεταξύ ατόμων άνθρακα και υδρογόνου, των οποίων ο γενικός τύπος είναι ΝΤΟόχιΗ2n + 2.
Χαρακτηριστικά αλκανίων
- Ονομάζονται επίσης παραφίνες ή παραφίνες.
- Βρίσκονται στη φύση σε φυσικό αέριο και πετρέλαιο.
- Χρησιμοποιούνται ως καύσιμα: μαγειρικό αέριο, βενζίνη, πετρέλαιο κ.λπ.
Παραδείγματα αλκανίων

αλκένια
Είναι υδρογονάνθρακες ανοιχτής αλυσίδας και έχουν διπλό δεσμό, του οποίου ο γενικός τύπος είναι ΝΤΟόχιΗ2η.
Χαρακτηριστικά αλκενίων
- Ονομάζονται επίσης ολεφίνες, αλκένια ή αιθυλενικοί υδρογονάνθρακες.
- Λαμβάνονται βιομηχανικά από το σπάσιμο των αλκανίων που υπάρχουν στο πετρέλαιο.
- Χρησιμοποιούνται ως πρώτη ύλη στη βιομηχανία: πλαστικά, βαφές, εκρηκτικά κ.λπ.
Παραδείγματα αλκενίων

Αλκίνες
Είναι υδρογονάνθρακες ανοιχτής αλυσίδας με την παρουσία ενός διπλού δεσμού, του οποίου ο γενικός τύπος είναι ΝΤΟόχιΗ2n-2.
Χαρακτηριστικά Αλκίνων
- Είναι πιο αντιδραστικά από τα αλκάνια και τα αλκένια λόγω του τριπλού δεσμού.
- Τα αλκύνια με περισσότερα από 14 άτομα άνθρακα είναι στερεά.
- Το πιο χρησιμοποιούμενο αλκύνιο είναι το ακετυλένιο, που χρησιμοποιείται συνήθως στην παραγωγή συνθετικών ελαστικών, υφαντικών ινών και πλαστικών.
Παραδείγματα αλκυνών

Αλκαδιένους
Είναι υδρογονάνθρακες ανοιχτής αλυσίδας και η παρουσία δύο διπλών δεσμών, των οποίων ο γενικός τύπος είναι ΝΤΟόχιΗ2n-2
Χαρακτηριστικά των αλκαδιενίων
- Ονομάζονται επίσης διένια ή διολεφίνες
- Βρίσκονται στη φύση σε τερπένια, τα οποία εξάγονται από αιθέρια έλαια φρούτων.
- Η πιο γνωστή ένωση είναι το ισοπρένιο, που βρίσκεται στο φυσικό καουτσούκ και τα αιθέρια έλαια.
Παραδείγματα αλκαδιενίων

Κυκλάνοι
Είναι υδρογονάνθρακες κλειστής αλυσίδας με απλούς δεσμούς μεταξύ ατόμων άνθρακα και υδρογόνου, των οποίων ο γενικός τύπος είναι ΝΤΟόχιΗ2η.
Χαρακτηριστικά κυκλάν
- Ονομάζονται επίσης κυκλοαλκάνια ή κυκλοπαραφίνες.
- Είναι ασταθείς όταν υπόκεινται σε υψηλή πίεση.
- Οι αλυσίδες με περισσότερους από 6 άνθρακες είναι σταθερές, ενώ οι αλυσίδες με λιγότερους από 5 άνθρακες είναι αντιδραστικές.
Παραδείγματα κυκλάνων

Κύκλοι
Είναι υδρογονάνθρακες κλειστής αλυσίδας με την παρουσία ενός διπλού δεσμού, του οποίου ο δομικός τύπος είναι ΝΤΟόχιΗ2n-2.
Χαρακτηριστικά των κυκλενίων
- Ονομάζονται επίσης κυκλοαλκένια.
- Οι ενώσεις από 3 έως 5 άνθρακες είναι ασταθείς.
- Βρίσκονται συνήθως σε φυσικό αέριο, πετρέλαιο και πετρέλαιο.
Παραδείγματα κυκλενίων
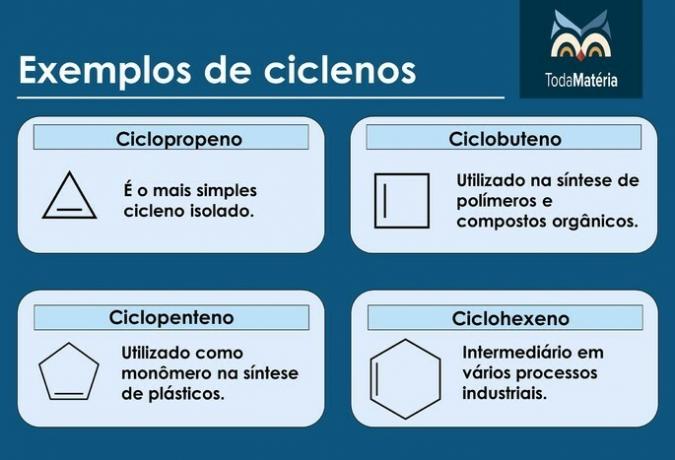
ποδηλάτες
Είναι υδρογονάνθρακες κλειστής αλυσίδας με την παρουσία τριπλού δεσμού, του οποίου ο δομικός τύπος είναι ΝΤΟόχιΗ2n-4.
Χαρακτηριστικά ποδηλασίας
- Ονομάζονται επίσης κυκλοαλκύνια ή κυκλοαλκύνια.
- Είναι κυκλικοί και ακόρεστοι υδρογονάνθρακες.
- Είναι ασταθείς λόγω τριπλού δεσμού και δεν βρίσκονται στη φύση.
Παραδείγματα κύκλων

Αρωματικά
Είναι υδρογονάνθρακες κλειστής αλυσίδας με εναλλασσόμενους μονό και διπλούς δεσμούς.
Χαρακτηριστικά αρωματικών
- Ονομάζονται επίσης αρένες.
- Είναι ακόρεστες ενώσεις, καθώς έχουν 3 διπλούς δεσμούς.
- Αποτελούνται από τουλάχιστον έναν αρωματικό δακτύλιο.
Παραδείγματα αρωματικών
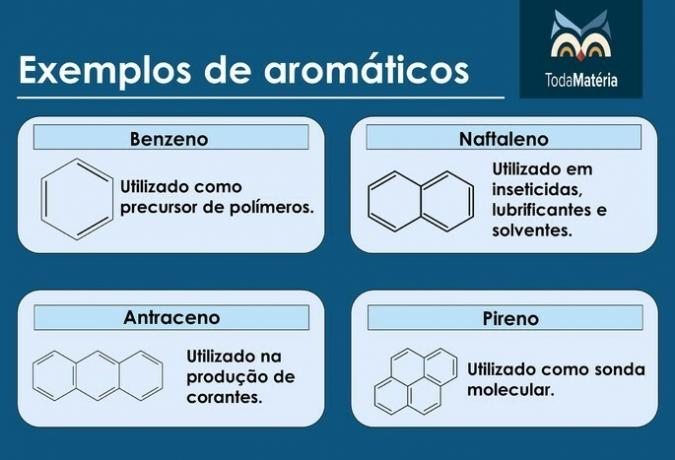
- Πετρέλαιο
- διύλιση πετρελαίου
- Ασετυλίνη
Περίληψη υδρογονανθράκων
| Κατοχή | Γενική φόρμουλα |
Χαρακτηριστικά |
|---|---|---|
| αλκανίου | Ανοιχτή αλυσίδα με απλούς συνδέσμους. |
|
| αλκένιο | Ανοιχτή αλυσίδα με διπλό δεσμό. | |
| αλκύνιο | Ανοιχτή αλυσίδα με τριπλό δεσμό. | |
| αλκαδιένιο | Ανοιχτή αλυσίδα με δύο διπλούς δεσμούς. | |
| Κυκλάνοι | Κλειστή αλυσίδα με απλές συνδέσεις. | |
| Κύκλοι | Κλειστή αλυσίδα με διπλό δεσμό. | |
| ποδηλάτες | Κλειστή αλυσίδα με τριπλό σύνδεσμο. | |
| Αρωματικός | Μεταβλητός | Κλειστή αλυσίδα με εναλλασσόμενους μονό και διπλούς δεσμούς. |
Ασκήσεις σε Υδρογονάνθρακες
1. (UEMA) Το LPG (Liquefied Petroleum Gas), επίσης γνωστό ως μαγειρικό αέριο, είναι καύσιμο μη ανανεώσιμα απολιθώματα που μπορεί να εξαντληθεί μια νύχτα αν δεν χρησιμοποιηθεί με προγραμματισμό και χωρίς υπέρβαση. Αποτελείται, μεταξύ άλλων αερίων, από προπάνιο C3Η8, βουτάνιο C4Η10 και μικρές ποσότητες προπυλενίου C3Η6 και βουτένιο Γ4Η8. Αυτές οι οργανικές ενώσεις ταξινομούνται ως υδρογονάνθρακες που έχουν ομοιότητες και διαφορές μεταξύ τους. Με βάση τον τύπο δεσμού μεταξύ των ανθράκων και την ταξινόμηση της αλυσίδας άνθρακα των παραπάνω ενώσεων, μπορεί να δηλωθεί ότι:
α) οι ακόρεστες ενώσεις είναι προπάνιο και βουτάνιο.
β) οι ακόρεστες ενώσεις είναι προπένιο και βουτένιο.
γ) οι ακόρεστες ενώσεις είναι προπένιο και βουτάνιο.
δ) οι ενώσεις έχουν ομοκυκλικές αλυσίδες.
ε) οι ενώσεις έχουν ετεροκυκλικές αλυσίδες.
Εναλλακτική β) οι ακόρεστες ενώσεις είναι προπένιο και βουτένιο.
Α) ΛΑΘΟΣ. Αυτές οι ενώσεις δεν έχουν ακόρεστα, οι δεσμοί τους είναι απλοί.
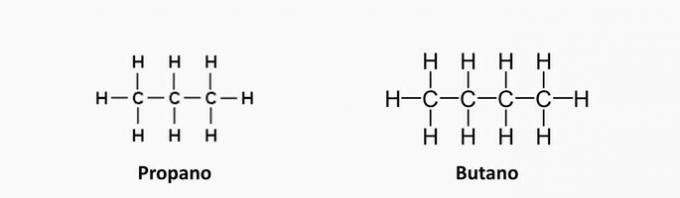
β) ΣΩΣΤΗ. Ο όρος «en» υποδηλώνει την παρουσία διπλών δεσμών στις ενώσεις.

γ) ΛΑΘΟΣ. Το βουτάνιο δεν έχει ακόρεστα.

δ) ΛΑΘΟΣ. Αυτές οι αλυσίδες είναι κλειστές και τα άτομα άνθρακα συνδέονται με απλούς δεσμούς.
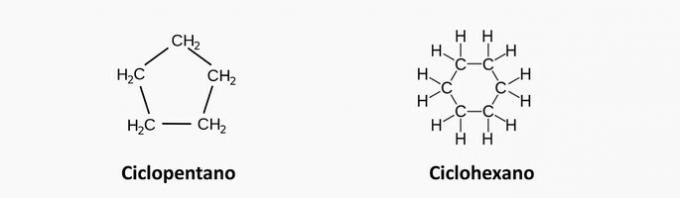
ε) ΛΑΘΟΣ. Αυτές οι αλυσίδες έχουν ετεροάτομο, όπως οξυγόνο και άζωτο.

2. (Uel) Ένας από τους υδρογονάνθρακες του τύπου C5Η12 μπορεί να έχει αλυσίδα άνθρακα:
α) κορεσμένος κυκλικός.
β) ετερογενής ακυκλικός.
γ) διακλαδισμένη κυκλική.
δ) ακόρεστο ανοιχτό.
ε) ανοιχτό διακλαδισμένο.
Εναλλακτική ε) ανοιχτή διακλαδισμένη.
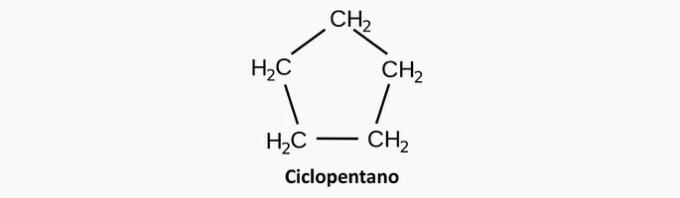
Α) ΛΑΘΟΣ. Μια κορεσμένη κυκλική ένωση αντιστοιχεί σε μια κυκλάνη, της οποίας ο τύπος είναι CόχιΗ2η.
Παράδειγμα:
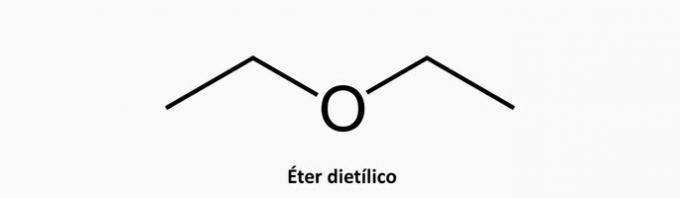
β) ΛΑΘΟΣ. Μια ετερογενής κυκλική ένωση έχει την παρουσία ενός άλλου στοιχείου επιπλέον του παρεμβαλλόμενου άνθρακα στην αλυσίδα.
Παράδειγμα:
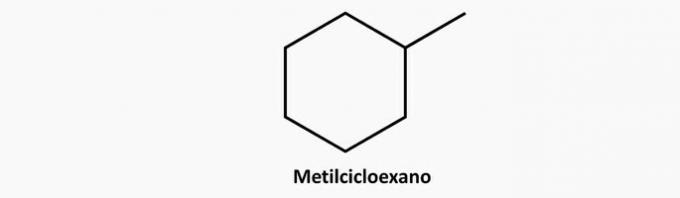
γ) ΛΑΘΟΣ. Μια διακλαδισμένη κυκλική ένωση έχει τον τύπο ΓόχιΗ2η.
Παράδειγμα:
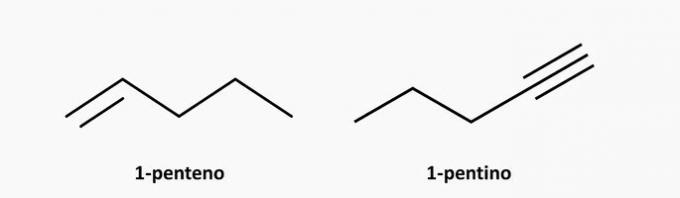
δ) ΛΑΘΟΣ. Μια ακόρεστη ένωση ανοικτής αλυσίδας μπορεί να είναι αλκένιο ή αλκύνιο, ο τύπος της οποίας είναι αντίστοιχα C.όχιΗ2η και ΓόχιΗ2n-2.
Παραδείγματα:
ε) ΣΩΣΤΗ. Μια διακλαδισμένη ένωση ανοιχτής αλυσίδας είναι ένα αλκάνιο του οποίου ο τύπος είναι CόχιΗ2n + 2. Μια ένωση από 5 άνθρακες και 12 υδρογόνα θα μπορούσε να είναι ισοπεντάνιο.
Παράδειγμα:
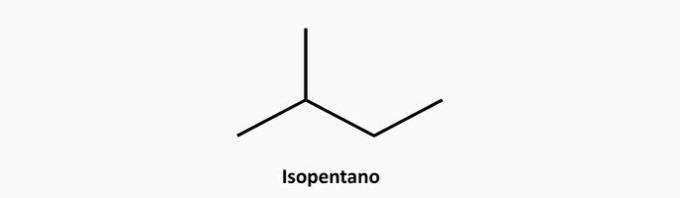
3. (PUC) Τα αλκύνια είναι υδρογονάνθρακες:
α) κορεσμένα αλειφατικά.
β) κορεσμένα αλικυκλικά.
γ) ακόρεστα αλειφατικά διπλού δεσμού.
δ) ακόρεστα αλικυκλικά τριπλού δεσμού.
ε) τριπλής σύνδεσης ακόρεστα αλειφατικά.
Εναλλακτική ε) ακόρεστα αλειφατικά τριπλού δεσμού.
Α) ΛΑΘΟΣ. Οι ενώσεις ανοιχτής αλυσίδας και μονής σύνδεσης είναι αλκάνια.
Παράδειγμα:

β) ΛΑΘΟΣ. Οι κυκλικές ενώσεις με απλούς δεσμούς είναι κυκλάνες.
Παράδειγμα:
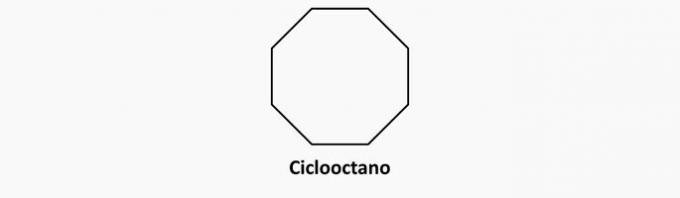
γ) ΛΑΘΟΣ. Οι ενώσεις ανοιχτής αλυσίδας και διπλής σύνδεσης είναι αλκένια.
Παράδειγμα:
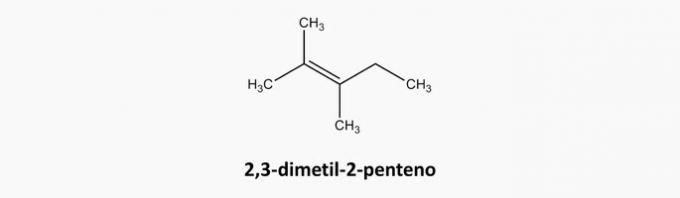
δ) ΛΑΘΟΣ. Οι κυκλικές και τριπλά συνδεδεμένες ενώσεις είναι κυκλίνες.
Παράδειγμα:
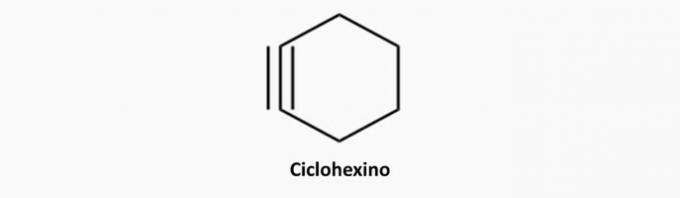
ε) ΣΩΣΤΗ. Οι αλκίνες είναι ενώσεις ανοιχτής αλυσίδας και τριπλής σύνδεσης.

Θέλετε να συνεχίσετε να δοκιμάζετε τις γνώσεις σας; Φροντίστε να δείτε αυτές τις λίστες:
- Ασκήσεις σε Υδρογονάνθρακες
- Ασκήσεις οργανικής χημείας
- Ασκήσεις σε οργανικές λειτουργίες



