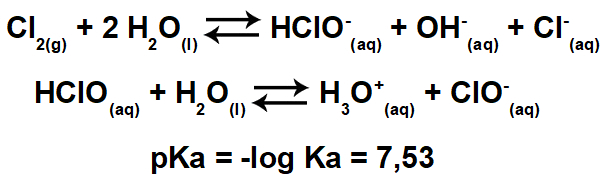Οι ενδοθερμικές και εξωθερμικές αντιδράσεις είναι ποσότητες που μετρούν την ποσότητα θερμότητας (ενέργειας) που απορροφάται και απελευθερώνεται κατά τη διάρκεια χημικών αντιδράσεων. Μελετούνται από τη θερμοχημεία.
Ποια είναι η διαφορά μεταξύ τους;
ενδοθερμική αντίδραση είναι αυτό στο οποίο υπάρχει απορρόφηση ενέργειας. Σε αυτήν τη διαδικασία, η ενέργεια παράγεται και διατηρείται ανεξάρτητα.
Τα πουλιά και τα θηλαστικά έχουν την ικανότητα να διατηρούν σταθερή θερμοκρασία σώματος. Για το λόγο αυτό καλούνται ενδοθερμικά ζώα, ευρέως «θερμόαιμα ζώα».
Εξωθερμική αντίδραση είναι αυτό στο οποίο υπάρχει απελευθέρωση ενέργειας. Σε αυτήν τη διαδικασία, η παραγωγή ενέργειας επιμένει μόνο μέσω της συνεχούς παροχής ενέργειας.
Η αλλαγή φυσικών καταστάσεων, με αυτή τη σειρά: αέριο, υγρό και στερεό, είναι ένα παράδειγμα μιας εξώθερμης αντίδρασης. Καθένα από αυτά συμβαίνει καθώς απελευθερώνεται ενέργεια, δηλαδή όταν υπάρχει λιγότερη θερμότητα.
Σημειώστε ότι όταν αντιστρέφουμε αυτήν τη σειρά (στερεό, υγρό και αέριο), παράγεται ενέργεια (περισσότερη θερμότητα). Σε αυτήν την περίπτωση, η αντίδραση είναι ενδοθερμική.
Καθημερινά παραδείγματα
Το σωματικό λίπος δρα ως καύσιμο στο σώμα μας. Αυτό που δεν καίγεται απορροφάται από αυτό. Καθώς πρόκειται για διαδικασία απορρόφησης, είναι ένα παράδειγμα ενδοθερμικής αντίδρασης.
Όταν τοποθετούμε ένα τηγάνι στη φωτιά για να προετοιμάσουμε φαγητό, με τη σειρά μας αντιμετωπίζουμε μια εξώθερμη διαδικασία. Αυτό συμβαίνει επειδή η θερμότητα που απελευθερώνεται θα μετατρέψει αυτό το φαγητό έτσι ώστε να μπορεί να καταναλωθεί.
Και τι είναι το Enthalpy;
ενθαλπία Είναι η ενέργεια που υπάρχει σε όλες τις ουσίες και μεταβάλλεται ως αποτέλεσμα ενδοθερμικών και εξωθερμικών αντιδράσεων.
Δεδομένου ότι δεν είναι δυνατόν να υπολογιστεί η ενθαλπία, ο υπολογισμός της παραλλαγής του έγινε.
Έτσι, συγκρίνοντας την τυπική ενθαλπία (θερμοκρασία 25ºC υπό ατμοσφαιρική πίεση 1atm), θα ήταν δυνατό να υπολογιστεί η παραλλαγή της ενθαλπίας.
Σύμφωνα με την Νόμος του Έσση, η τελική ενθαλπία μείον την αρχική ενθαλπία (ΔΗ = Ηφά - ΧΕγώ) αποτελέσματα σε αυτά τα δεδομένα.
Εάν η ενδοθερμική αντίδραση απορροφά ενέργεια, αυτό σημαίνει ότι η ενθαλπία του (τελικού) αντιδραστηρίου είναι χαμηλότερη από εκείνη του (αρχικού) προϊόντος. Επομένως, η αλλαγή της ενθαλπίας είναι θετική (ΔΗ> 0).
Με τη σειρά του, εάν η εξώθερμη αντίδραση απελευθερώνει ενέργεια, αυτό σημαίνει ότι η ενθαλπία (ενέργεια) του αντιδρώντος είναι μεγαλύτερη από εκείνη του προϊόντος. Επομένως, η παραλλαγή της ενθαλπίας είναι αρνητική (ΔΗ
Διαβάστε επίσης:
- Χημικές αντιδράσεις
- Χημική ισορροπία
- Καύση