Ερωτήσεις σχετικά με χημικά ισοζύγια στο Enem είναι πολύ επαναλαμβανόμενα. Έχοντας αυτό υπόψη, δημιουργήσαμε αυτό το υλικό, το οποίο φέρνει τα πιο σημαντικά θέματα σχετικά με αυτόν τον κλάδο της Φυσικής Χημείας που καλύπτεται στις εξετάσεις του Εθνικού Λυκείου (Enem)
Μεταξύ των θεμάτων που σχετίζονται με τη χημική ισορροπία, έχουμε σταθερά ισορροπίας όσον αφορά τη συγκέντρωση σε mol / L και από την άποψη της πίεσης, ιοντική σταθερά ισορροπίας, σταθερά ιονισμού, μετατόπιση ισορροπίας, pH και pOH, σταθερά υδρόλυσης, ρυθμιστικό και σταθερά διαλυτότητα.
Μεταξύ των θεμάτων που περιγράφονται παραπάνω, μερικά από αυτά αποκτούν μεγαλύτερη προβολή στο Enem:
Μετατόπιση ισορροπίας
Σταθερή ιονισμού
pH
αλατούχο υδρόλυση
Μάθημα βίντεο για την χημική ισορροπία στο Enem
1. Μετατόπιση ισορροπίας στο Enem
1.1- (Enem 2015) Η υποξία ή η ασθένεια υψομέτρου συνίστανται σε μειωμένο οξυγόνο (Ο2) στο αρτηριακό αίμα του σώματος. Για το λόγο αυτό, πολλοί αθλητές αντιμετωπίζουν δυσφορία (πονοκεφάλους, ζάλη, δύσπνοια) όταν ασκούν σωματική δραστηριότητα σε μεγάλα υψόμετρα. Υπό αυτές τις συνθήκες, θα υπάρξει μείωση της συγκέντρωσης οξυγονωμένης αιμοσφαιρίνης (HbO
2) σε ισορροπία στο αίμα, ανάλογα με τη σχέση: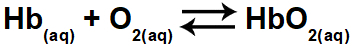
Η αλλαγή στη συγκέντρωση της οξυγονωμένης αιμοσφαιρίνης στο αίμα συμβαίνει λόγω:
α) την αύξηση της αρτηριακής πίεσης.
β) την αύξηση της θερμοκρασίας του σώματος.
γ) μείωση της θερμοκρασίας του περιβάλλοντος.
δ) τη μείωση της μερικής πίεσης του οξυγόνου.
ε) τη μείωση της ποσότητας των ερυθρών αιμοσφαιρίων.
Οξυγονωμένη αιμοσφαιρίνη (HbO2) βρίσκεται στα αντιδραστήρια (δεξιά πλευρά) της εξίσωσης. Η άσκηση ρωτά ποια από τις επιλογές θα οδηγήσει σε αλλαγή της οξυγονωμένης αιμοσφαιρίνης στο αίμα, δηλαδή, θα μετατοπίζει την ισορροπία προς τα αριστερά ή προς τα δεξιά.
α) Λάθος. Η αυξημένη ροή αίματος δεν έχει καμία σχέση με την αυξημένη αρτηριακή πίεση.
β) Λάθος. Η θερμοκρασία δεν αλλάζει την παρεχόμενη ισορροπία.
γ) Λάθος. Η θερμοκρασία δεν αλλάζει την παρεχόμενη ισορροπία.
δ) Αλήθεια. Η μείωση της μερικής πίεσης του οξυγόνου μειώνει την ποσότητα της οξυγονωμένης αιμοσφαιρίνης, μετατοπίζοντας την ισορροπία προς τα αριστερά.
ε) Λάθος. Η μείωση του αριθμού των ερυθρών αιμοσφαιρίων θα προκαλέσει τόσο τον αριθμό αιμοσφαιρινών όσο και τις οξυγονωμένες αιμοσφαιρίνες.
1.2- (Enem 2011) Τα αναψυκτικά έχουν γίνει όλο και περισσότεροι στόχοι των πολιτικών δημόσιας υγείας. Τα προϊόντα κόλλας περιέχουν φωσφορικό οξύ, μια ουσία που είναι επιβλαβής για τη στερέωση του ασβεστίου, ένα μέταλλο που είναι το κύριο συστατικό της μήτρας των δοντιών. Το Caries είναι μια δυναμική διαδικασία ανισορροπίας στη διαδικασία της αποδυνάμωσης των δοντιών, απώλεια ορυκτών λόγω της οξύτητας. Είναι γνωστό ότι το κύριο συστατικό του σμάλτου των δοντιών είναι ένα άλας που ονομάζεται υδροξυαπατίτης. Η σόδα, με την παρουσία σακχαρόζης, μειώνει το pH του βιοφίλμ (βακτηριακή πλάκα), προκαλώντας την απομετάλλωση του οδοντικού σμάλτου. Οι μηχανισμοί άμυνας των σιελογόνων χρειάζονται 20 λεπτά έως 30 λεπτά για να ομαλοποιήσουν το επίπεδο του pH, επαναπροσδιορίζοντας το δόντι Η ακόλουθη χημική εξίσωση αντιπροσωπεύει αυτήν τη διαδικασία:

Λαμβάνοντας υπόψη ότι ένα άτομο καταναλώνει αναψυκτικά καθημερινά, μπορεί να προκύψει μια διαδικασία αφαλάτωσης των δοντιών ως αποτέλεσμα της αύξησης της συγκέντρωσης:
α) ΟΗ-, που αντιδρά με ιόντα Ca2+, μετατόπιση ισορροπίας προς τα δεξιά.
β) Η+, που αντιδρά με τα υδροξυλικά ΟΗ-, μετατόπιση ισορροπίας προς τα δεξιά.
γ) ΟΗ-, που αντιδρά με ιόντα Ca2+, μετατόπιση ισορροπίας προς τα αριστερά.
δ) Η+, που αντιδρά με τα υδροξυλικά ΟΗ-, μετατόπιση ισορροπίας προς τα αριστερά.
ε) Ca2+, που αντιδρά με τα υδροξυλικά ΟΗ-, μετατόπιση ισορροπίας προς τα αριστερά.
Σωστή απάντηση: Γράμμα Β
Ανάλυση
Η διαδικασία απομετάλλωσης μετατοπίζει την ισορροπία προς τα δεξιά. Όταν ένα άτομο πίνει σόδα, καταναλώνει ένα όξινο υλικό, δηλαδή αυξάνει την ποσότητα του H+ στη μέση. το Η+ αλληλεπιδρά γρήγορα με το OH- ισορροπίας, μειώνοντας την ποσότητα του ΟΗ-. Με αυτόν τον τρόπο, η ισορροπία μετατοπίζεται προς τα δεξιά, αφαλατώνοντας το δόντι.
1.3- (Enem-2013) Ένα από τα στάδια της επεξεργασίας νερού είναι η απολύμανση, με τη χλωρίωση να είναι η πιο χρησιμοποιούμενη μέθοδος. Αυτή η μέθοδος συνίσταται στη διάλυση αερίου χλωρίου σε διάλυμα υπό πίεση και την εφαρμογή του στο νερό που θα απολυμανθεί. Οι σχετικές εξισώσεις χημικής αντίδρασης είναι:

Η απολυμαντική δράση ελέγχεται από υποχλωριώδες οξύ, το οποίο έχει δυναμικό απολύμανσης περίπου 80 φορές μεγαλύτερο από το υποχλωριώδες ανιόν. Το ρΗ του μέσου είναι σημαντικό επειδή επηρεάζει την έκταση στην οποία ιονίζεται το υποχλωριώδες οξύ. Για να είναι πιο αποτελεσματική η απολύμανση, το pH του νερού που πρέπει να υποβληθεί σε επεξεργασία πρέπει να είναι πιο κοντά στο:
α) 0
β) 5
γ) 7
δ) 9
ε) 14
Σωστή απάντηση: Γράμμα Β
Σύμφωνα με το κείμενο, η καλύτερη απολυμαντική δράση πραγματοποιείται από την ουσία HClO. Επομένως, κάθε ερμηνεία και συμπέρασμα πρέπει να κατευθύνονται προς έναν τρόπο απόκτησης αυτής της ουσίας.
Η ουσία HClO υπάρχει στη δεύτερη ισορροπία, οπότε μια ενδιαφέρουσα τακτική είναι η μετατόπιση αυτής της ισορροπίας προς τα αριστερά. Για αυτό, σύμφωνα με το αρχή του Le Chatelier, έχουμε την επιλογή να αυξήσουμε την ποσότητα H+ (προσθήκη όξινης ουσίας, pH μικρότερο από 7) ή αύξηση της ποσότητας Cl-.
Αξίζει να σημειωθεί ότι, στην πρώτη εξίσωση, υπάρχει μια άλλη χημική ισορροπία, η οποία παρουσιάζει το είδος HClO-, η οποία έχει σχέση με τον Η+, μετατόπιση ισορροπίας προς τα αριστερά. Αυτή είναι μια κίνηση που δεν θέλουμε.
Επομένως, πρέπει να χρησιμοποιήσουμε ένα όξινο pH (κάτω από 7). Ωστόσο, αυτό το pH δεν πρέπει να είναι πολύ όξινο για να αποφευχθούν πολλά κατιόντα Η.+ στη μέση.
Δείτε επίσης:Χημική ισορροπία σε σπηλιές
2. Υδρόλυση pH και αλατούχου διαλύματος σε Enem
2.1- (Enem-2017) Διάφορα φυσικά προϊόντα μπορούν να ληφθούν από φυτά μέσω της διαδικασίας εκχύλισης. Η Lapachol ανήκει στην κατηγορία ναφθοκινόνης. Η δομή του έχει ένα ενοξύ υδροξυλίου (pKa = 6.0) που επιτρέπει σε αυτήν την ένωση να απομονωθεί από το πριονίδι ipe με εκχύλιση με ένα κατάλληλο διάλυμα, ακολουθούμενο από απλή διήθηση. Σκεφτείτε ότι το pKa = -log Ka και ότι το Ka είναι η σταθερά οξέος της αντίδρασης ιονισμού λαπαχόλης.

Ποια λύση πρέπει να χρησιμοποιηθεί για την πιο αποτελεσματική εξαγωγή λαπαχόλης από το πριονίδι ipê;
α) διάλυμα Na2CO3 για να σχηματίσουν ένα αλάτι λαπαχόλης.
β) Ρυθμιστικό διάλυμα οξικού οξέος / οξικού νατρίου (ρΗ = 4,5).
γ) διάλυμα NaCI για να αυξηθεί η ιοντική ισχύς του μέσου.
δ) διάλυμα Na2ΜΟΝΟ4 για να σχηματίσουν ένα ζεύγος ιόντων με λαπαχόλη.
ε) διάλυμα HCI για να το εκχυλίσει μέσω αντίδρασης οξέος-βάσης.
Η δήλωση δείχνει ότι το pKa της ουσίας είναι 6.0. Αυτή η τιμή pKa πρέπει να χρησιμοποιηθεί στην έκφραση pKa:
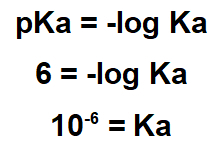
Καθώς το Ka είναι μικρό, η λαπαχόλη είναι όξινη ουσία, οπότε για να την αφαιρέσετε, είναι χρήσιμο να χρησιμοποιήσετε μια βασική ουσία.
μια αληθεια. Το αλάτι είναι βασικό, καθώς προέρχεται από μια ισχυρή βάση (επειδή προέρχεται από την οικογένεια IA), και CO3 προέρχεται από ένα ασθενές οξύ (Η2CO3).
β) Λάθος. Το ρυθμιστικό διάλυμα είναι όξινο και χρειαζόμαστε μια βάση.
γ) Λάθος. Το NaCl είναι ουδέτερο άλας, καθώς προέρχεται από ισχυρή βάση (επειδή προέρχεται από την οικογένεια IA) και το Cl προέρχεται από ισχυρό οξύ (HCl).
δ) Λάθος. Στο2ΜΟΝΟ4 είναι ένα ουδέτερο αλάτι, καθώς το Na προέρχεται από μια ισχυρή βάση (επειδή προέρχεται από την οικογένεια IA), και SO4 προέρχεται από ένα ισχυρό οξύ (Η2ΜΟΝΟ4).
είναι ψεύτικο. Το HCl είναι ένα οξύ και χρειαζόμαστε μια βάση.
2.2- (Enem- 2014) Με στόχο την ελαχιστοποίηση των περιβαλλοντικών επιπτώσεων, η νομοθεσία της Βραζιλίας καθορίζει ότι τα χημικά κατάλοιπα που απελευθερώνονται απευθείας στον οργανισμό λήψης έχουν pH μεταξύ 5,0 και 9,0. Ένα υδατικό υγρό απόβλητο που παράγεται σε μια βιομηχανική διεργασία έχει συγκέντρωση ιόντων υδροξυλίου ίση με 1.0.10-10 φίλη αλήτη. Για να συμμορφωθεί με τη νομοθεσία, ένας φαρμακοποιός διαχώρισε τις ακόλουθες ουσίες, διαθέσιμες στην αποθήκη της εταιρείας: CH3COOH, Να2SO4, CH3ΟΗ, Κ2CO3 και ΝΗ4Κλ.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Για να απελευθερωθεί το υπόλειμμα απευθείας στο σώμα υποδοχής, ποια ουσία θα μπορούσε να χρησιμοποιηθεί για τη ρύθμιση του pH;
α) CH3COOH
β) Σε2ΜΟΝΟ4
γ) CH3Ω
δ) Κ2CO3
ε) ΝΗ4Κλ
Σωστή απάντηση: Γράμμα Δ
Ανάλυση
Βήμα 1: Προσδιορίστε το pH του υπολείμματος.
Η άσκηση δείχνει ότι το υπόλειμμα έχει συγκέντρωση υδροξειδίου ίση με 10-10.
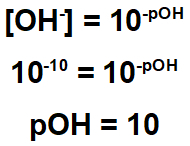
Επομένως, μπορούμε να υπολογίσουμε το pH αυτού του υπολείμματος:

Από τα παραπάνω, έχουμε ότι το υπόλειμμα έχει όξινο χαρακτήρα, καθώς το pH του είναι μικρότερο από 7. Έτσι, για να την εξουδετερώσετε, είναι απαραίτητο να χρησιμοποιήσετε μια ουσία με βασικό χαρακτήρα.
Βήμα 2: Προσδιορίστε το χαρακτήρα κάθε αλατιού για να δείξετε ποιο είναι βασικό, όπως το CH3Το COOH (εναλλακτική α) είναι ένα οξύ και CH3Το OH (εναλλακτική γ) είναι αλκοόλη, οργανική κατηγορία με όξινο χαρακτήρα.
β) Ουδέτερο αλάτι, καθώς το Na προέρχεται από μια ισχυρή βάση (επειδή προέρχεται από την οικογένεια IA), και το SO4 προέρχεται από ένα ισχυρό οξύ (Η2ΜΟΝΟ4).
δ) Βασικό αλάτι, καθώς το Κ προέρχεται από μια ισχυρή βάση (επειδή προέρχεται από την οικογένεια IA), και CO3 προέρχεται από ένα ασθενές οξύ (Η2CO3).
ε) Όξινο άλας, ως ΝΗ4 προέρχεται από μια αδύναμη βάση (NH4ΟΗ) και το Cl προέρχεται από ένα ισχυρό οξύ (HCl).
2.3- (Enem- 2014) Ένας ερευνητής παρατηρεί ότι η ετικέτα σε ένα από τα βάζα στα οποία διατηρεί συμπύκνωμα πεπτικών ενζύμων είναι δυσανάγνωστη. Δεν ξέρει ποιο ένζυμο περιέχει το γυαλί, αλλά υποψιάζεται ότι είναι μια γαστρική πρωτεάση, η οποία λειτουργεί στο στομάχι χωνεύοντας πρωτεΐνες. Γνωρίζοντας ότι η πέψη στο στομάχι είναι όξινο και το έντερο είναι βασικό, συγκεντρώνει πέντε δοκιμαστικούς σωλήνες με τροφή διαφορετικά, προσθέστε το συμπύκνωμα ενζύμου σε διαλύματα με καθορισμένο pH και περιμένετε να δείτε εάν το ένζυμο δρα σε κάποιο δικα τους. Ο δοκιμαστικός σωλήνας στον οποίο το ένζυμο πρέπει να δράσει για να δείξει ότι η υπόθεση του ερευνητή είναι σωστή είναι αυτή που περιέχει:
α) κύβος πατάτας σε διάλυμα με pH = 9.
β) κομμάτι κρέατος σε διάλυμα με pH = 5.
γ) βρασμένο ασπράδι αυγού σε διάλυμα με pH = 9.
δ) μερίδα χυλοπίτες σε διάλυμα με pH = 5.
ε) σφαίρα βουτύρου σε διάλυμα με pH = 9.
Σωστή απάντηση: Γράμμα Β
Η άσκηση απαιτεί από τον μαθητή καλή ερμηνεία και συσχέτιση με τις βιοχημικές γνώσεις των τροφίμων. Ενημερώνει ότι ο ερευνητής πιστεύει ότι το ένζυμο είναι πεπτικό, δρα σε όξινο pH και δρα στις πρωτεΐνες (επειδή είναι πρωτεάση).
Εάν αυτό το ένζυμο δρα σε όξινο περιβάλλον, το pH πρέπει να είναι μικρότερο από 7. Το κρέας αποτελείται από πρωτεΐνες, ενώ τα ζυμαρικά αποτελούνται από υδατάνθρακες. Έτσι, η σωστή απάντηση είναι εναλλακτική β.
2.4- (Enem- 2012) Μια νοικοκυρά έπεσε κατά λάθος νερό από την απόψυξη ενός ψαριού στο ψυγείο, το οποίο άφησε μια δυνατή και δυσάρεστη μυρωδιά μέσα στη συσκευή. Είναι γνωστό ότι η χαρακτηριστική οσμή των ψαριών οφείλεται σε αμίνες και ότι αυτές οι ενώσεις συμπεριφέρονται ως βάσεις. Στον πίνακα, αναφέρονται οι συγκεντρώσεις υδρογόνου ορισμένων υλικών που βρίσκονται στην κουζίνα, τις οποίες σκέφτεται να χρησιμοποιήσει η νοικοκυρά κατά τον καθαρισμό του ψυγείου.

Μεταξύ των υλικών που αναφέρονται, ποια είναι κατάλληλα για την ανακούφιση αυτής της μυρωδιάς;
α) Αλκοόλ ή σαπούνι
β) Χυμός λεμονιού ή αλκοόλ
γ) Χυμός λεμονιού ή ξύδι
δ) Χυμός λεμονιού, γάλα ή σαπούνι
ε) Σαπούνι ή ανθρακικό νάτριο
Σωστή απάντηση: Γράμμα Γ
Ανάλυση
Η άσκηση προτείνει μια προβληματική κατάσταση στην οποία το ψυγείο μιας νοικοκυράς έχει έντονη οσμή που προκαλείται από μια ουσία βασικής φύσης. Έτσι, αμφισβητείται ποια υλικά θα ήταν ενδιαφέροντα για την επίλυση του προβλήματος.
Για να εξουδετερωθεί μια βάση, είναι απαραίτητο να χρησιμοποιηθεί ένα υλικό όξινου χαρακτήρα ή με pH χαμηλότερο από 7. Πώς η άσκηση παρείχε τις τιμές των συγκεντρώσεων Η+ των υλικών, ήταν αρκετό να χρησιμοποιήσετε το καθένα στην παρακάτω έκφραση:

Ετσι:
Χυμός: pH = 2
Γάλα: pH = 6
Ξίδι: pH = 3
Αλκοόλ: pH = 8
Σαπούνι: pH = 12
Βαρέλι: pH = 12
Υλικά με όξινο χαρακτήρα είναι χυμός, ξύδι και γάλα. Έτσι, μόνο η εναλλακτική γ φέρνει υλικά όξινου χαρακτήρα.
3. Σταθερά ισορροπίας στο Enem
3.1- (Enem-2016) Μετά την πλήρη φθορά τους, τα ελαστικά μπορούν να καούν για παραγωγή ενέργειας. Μεταξύ των αερίων που παράγονται στην πλήρη καύση του βουλκανισμένου καουτσούκ, μερικά είναι ρύποι και προκαλούν όξινη βροχή. Για να αποφευχθεί η διαφυγή τους στην ατμόσφαιρα, αυτά τα αέρια μπορούν να διοχετεύονται σε ένα υδατικό διάλυμα που περιέχει μια κατάλληλη ουσία. Εξετάστε τις πληροφορίες ουσίας που αναφέρονται στον παρακάτω πίνακα:

Μεταξύ των ουσιών που αναφέρονται στον πίνακα, εκείνη που μπορεί να απομακρύνει αποτελεσματικά τα ρυπογόνα αέρια είναι (α)
α) φαινόλη.
β) πυριδίνη.
γ) μεθυλαμίνη.
δ) όξινο φωσφορικό κάλιο.
ε) όξινο θειικό κάλιο.
Σωστή απάντηση: Γράμμα Δ
Ανάλυση
Η άσκηση δημιουργεί μια προβληματική κατάσταση στην οποία τα ρυπογόνα αέρια προάγουν την όξινη βροχή. Στη συνέχεια, ρωτά ποιες από τις αναφερόμενες ουσίες θα ήταν ενδιαφέρον να εξουδετερώσουν αυτά τα αέρια και, κατά συνέπεια, να αποφύγουν όξινη βροχή.
Για να αποφευχθεί η όξινη βροχή, τα όξινα αέρια πρέπει να εξουδετερωθούν χρησιμοποιώντας ένα βασικό διάλυμα. Ουσίες με αυτό το χαρακτηριστικό είναι εκείνες που κατά προτίμηση απελευθερώνουν ομάδες ΟΗ- στη μέση. Στον πίνακα, η πυριδίνη, η μεθυλαμίνη και το όξινο φωσφορικό κάλιο είναι βασικές ουσίες.
Έτσι, για να προσδιορίσουμε την ουσία που είναι ικανή να απομακρύνει πιο αποτελεσματικά τα αέρια ρύπων, πρέπει να αναλύσουμε την τιμή της σταθεράς ιονισμού. Όσο μεγαλύτερη είναι η σταθερά, τόσο μεγαλύτερη είναι η ικανότητα απελευθέρωσης ΟΗ-. Ετσι το όξινο φωσφορικό κάλιο είναι η πιο κατάλληλη ουσία σε αυτήν την περίπτωση.
3.2- (Enem-2015) Αρκετά οξέα χρησιμοποιούνται σε βιομηχανίες που απορρίπτουν τα λύματά τους σε υδάτινα σώματα, όπως ποτάμια και λίμνες, τα οποία μπορούν να επηρεάσουν την περιβαλλοντική ισορροπία. Για να εξουδετερωθεί η οξύτητα, μπορεί να προστεθεί ανθρακικό άλας ασβεστίου στο απόβλητο σε κατάλληλες ποσότητες, καθώς παράγει διττανθρακικό άλας, το οποίο εξουδετερώνει το νερό. Οι εξισώσεις που εμπλέκονται στη διαδικασία παρουσιάζονται:

Με βάση τις τιμές των σταθερών ισορροπίας των αντιδράσεων II, III και IV, στα 25Ο C, ποια είναι η αριθμητική τιμή της σταθεράς ισορροπίας της αντίδρασης I;
α) 4,5x10-26
β) 5x10-5
γ) 0,8x10-9
δ) 0,2x105
ε) 2.2x1026
Σωστή απάντηση: Γράμμα Β
Ανάλυση
Αυτή η άσκηση συνεπάγεται συνεχή ιονισμό. Αρχικά, είναι σημαντικό να κατανοήσουμε ότι η εξίσωση I είναι στην πραγματικότητα το αποτέλεσμα (άθροισμα) των εξισώσεων II, III και IV. Επομένως, για να ξεκινήσουμε το ψήφισμα, πρέπει να χρησιμοποιήσουμε τις αρχές του ο νόμος του Έσση.
Βήμα 1: Χρήση του νόμου του Έσση.
Αντιστρέφοντας την εξίσωση II και διατηρώντας τις εξισώσεις III και IV, έχουμε:
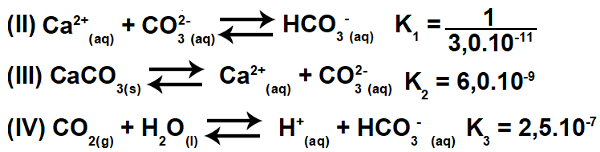
Έτσι, μπορούμε να παρατηρήσουμε ότι το ανιόν CO3-2 και το κατιόν Η+ θα εξαλειφθεί και το άθροισμα των εξισώσεων θα έχει ως αποτέλεσμα την εξίσωση Ι.
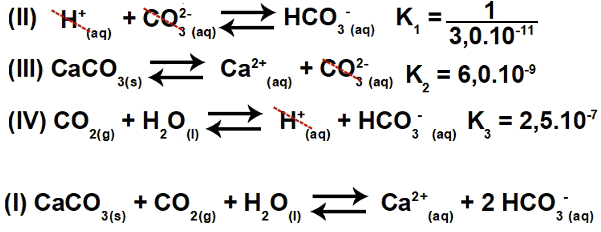
Βήμα 2: σταθερός υπολογισμός
Η σταθερά ισορροπίας της εξίσωσης ιονισμού δίνεται πάντα πολλαπλασιάζοντας τις σταθερές των άλλων εξισώσεων:

Από εμένα. Diogo Dias



