Τα πειράματα είναι ένας πρακτικός τρόπος για να μάθετε και να δοκιμάσετε τις γνώσεις σας για τις έννοιες που μελετήθηκαν στη Χημεία.
Επωφεληθείτε από αυτά τα χημικά πειράματα, τα οποία μπορούν να γίνουν στο σπίτι (υπό την επίβλεψη ενηλίκου) ή να εργαστούν στην τάξη με τον δάσκαλο, για να συμπληρώσουν τις σπουδές σας.
1η εμπειρία - ξετυλίγοντας τα χρώματα
Έννοιες που εμπλέκονται: χρωματογραφία και διαχωρισμός μιγμάτων
Υλικά
- στυλό (μαρκαδόροι) διαφόρων χρωμάτων
- αλκοόλ
- χαρτί φίλτρου καφέ
- κύπελλο (γυαλί για τη διευκόλυνση της παρακολούθησης του πειράματος)
Πως να φτιάξεις
- Χρησιμοποιήστε ψαλίδι και κομμένες λωρίδες χαρτιού φίλτρου. Για κάθε χρησιμοποιημένο στυλό, κάντε ένα ορθογώνιο.
- Τώρα, σε απόσταση περίπου 2 cm από τη βάση, σχεδιάστε έναν κύκλο με την επιλεγμένη έγχρωμη πένα και βάψτε όλο το εσωτερικό.
- Κολλήστε την άκρη του χαρτιού μακρύτερα από το σχεδιαζόμενο μάρμαρο σε ένα στήριγμα. Για αυτό, μπορείτε να χρησιμοποιήσετε μια ταινία και να την επισυνάψετε σε ένα μολύβι.
- Προσθέστε αλκοόλ στο φλιτζάνι, όχι πάρα πολύ, καθώς θα πρέπει να αγγίζει το άκρο του χαρτιού κοντά στο μαρκαδόρο.
- Τοποθετήστε το χαρτί στο κύπελλο έτσι ώστε να είναι κάθετο. Το μολύβι που το στηρίζει πρέπει να ακουμπά στις άκρες.
- Περιμένετε μεταξύ 10 και 15 λεπτών για να φτάσει το αλκοόλ μέσω του φίλτρου. Μετά από αυτό, αφαιρέστε τα χαρτιά και αφήστε τα να στεγνώσουν.
Αποτέλεσμα
Όταν το αλκοόλ περνά μέσα από το μαρκαδόρο, αλληλεπιδρά με τα χρωματικά συστατικά και τα οδηγεί σε όλο το χαρτί. Έτσι, οι διάφορες χρωστικές διαχωρίζονται με επαφή με αλκοόλη.
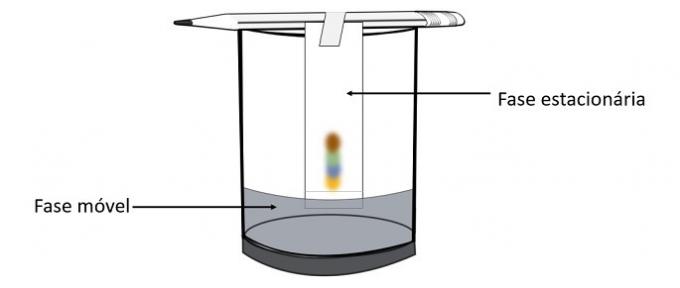
Μέσω αυτού του πειράματος είναι δυνατόν να γνωρίζουμε ποια χρώματα αναμίχθηκαν για να δημιουργήσουν το χρώμα της πένας.
Εξήγηση
Η χρωματογραφία είναι ένας τύπος διαδικασίας για το διαχωρισμό των μιγμάτων. Το διηθητικό χαρτί είναι η στάσιμη φάση και το αλκοόλ είναι η κινητή φάση που σέρνει τα συστατικά του μείγματος καθώς περνά μέσα από τη στάσιμη φάση. Σε αυτήν τη διαδικασία, όσο μεγαλύτερη είναι η αλληλεπίδραση με το αλκοόλ, τόσο πιο γρήγορα θα κινείται η χρωστική ουσία με τη διέλευση του διαλύτη.
Τα συστατικά του υλικού, καθώς έχουν διαφορετικές ιδιότητες, θα αλληλεπιδράσουν με την κινητή φάση με διαφορετικούς τρόπους, κάτι που μπορεί να παρατηρηθεί από τους διαφορετικούς χρόνους έλξης στη στάσιμη φάση.
Μάθε περισσότερα για χρωματογραφία.
2η εμπειρία - συντήρηση τροφίμων
Εννοιολογικές έννοιες: οργανικές ενώσεις και χημικές αντιδράσεις
Υλικά
- μήλο, μπανάνα ή αχλάδι
- χυμό λεμονιού ή πορτοκάλι
- Δισκίο βιταμίνης C
Πως να φτιάξεις
- Επιλέξτε ένα από τα τρία φρούτα και κόψτε το σε 3 ίσα μέρη.
- Το πρώτο κομμάτι θα χρησιμεύσει ως σύγκριση με τα άλλα. Γι 'αυτό μην προσθέτετε τίποτα σε αυτό, απλώς αφήστε το εκτεθειμένο στον αέρα.
- Σε ένα από τα κομμάτια, στάγδην το περιεχόμενο ενός λεμονιού ή ενός πορτοκαλιού. Απλώστε έτσι ώστε ολόκληρο το εσωτερικό του φρούτου να καλύπτεται με χυμό.
- Στο τελευταίο μέρος, απλώστε τη βιταμίνη C, μπορεί να είναι ένα θρυμματισμένο δισκίο, σε όλο τον πολτό των φρούτων.
- Παρακολουθήστε τι συμβαίνει και συγκρίνετε τα αποτελέσματα.
Αποτέλεσμα
Ο πολτός του καρπού που έχει εκτεθεί στον αέρα θα πρέπει να σκοτεινιάσει γρήγορα. Ο χυμός λεμονιού ή πορτοκαλιού και η βιταμίνη C, μια χημική ουσία που ονομάζεται ασκορβικό οξύ, θα πρέπει να επιβραδύνουν την αμαύρωση των φρούτων.

Εξήγηση
Όταν κόβουμε έναν καρπό, τα κύτταρα του είναι κατεστραμμένα απελευθερώνοντας ένζυμα, όπως η πολυφαινόλη οξειδάση, τα οποία η επαφή με τον αέρα οξειδώνει τις φαινολικές ενώσεις που υπάρχουν στα τρόφιμα και προκαλεί ενζυματικό καφέ.
Για να αποφευχθεί η δράση του οξυγόνου, χρησιμοποιούνται συντηρητικά όπως το ασκορβικό οξύ επειδή είναι κατά προτίμηση οξειδωμένα στη θέση των φαινολικών ενώσεων. Εκτός από το δισκίο βιταμίνης C, το ασκορβικό οξύ υπάρχει επίσης σε φυσικές πηγές, όπως εσπεριδοειδή, λεμόνι και πορτοκάλι, που προτείνονται στο πείραμα.
Μάθε περισσότερα για οξείδωση.
3η εμπειρία - ποιος παγώνει πιο γρήγορα;
Έννοιες που εμπλέκονται: συνεργατικές ιδιότητες και κρυοσκόπηση
Υλικά
- δύο σωληνώσεις (χρησιμοποιούνται για πάρτι)
- γυάλινο μπολ
- επιτραπέζιο αλάτι
- φιλτραρισμένο νερό
- πάγος
- θερμόμετρο
Πως να φτιάξεις
- Προσθέστε την ίδια ποσότητα φιλτραρισμένου νερού και στους δύο σωλήνες. Για παράδειγμα, 5 mL σε κάθε σωλήνα.
- Προσθέστε το επιτραπέζιο αλάτι σε έναν από τους σωλήνες και τοποθετήστε μια ταινία αναγνώρισης για να διακρίνετε ποιο είναι αλμυρό.
- Γεμίστε το γυάλινο δοχείο με θρυμματισμένο πάγο και προσθέστε λίγο αλάτι.
- Τοποθετήστε τους δύο σωλήνες ταυτόχρονα μέσα στον πάγο και παρακολουθήστε τι συμβαίνει.
- Καταγράψτε τη θερμοκρασία κατάψυξης για κάθε κατάσταση.
Αποτέλεσμα
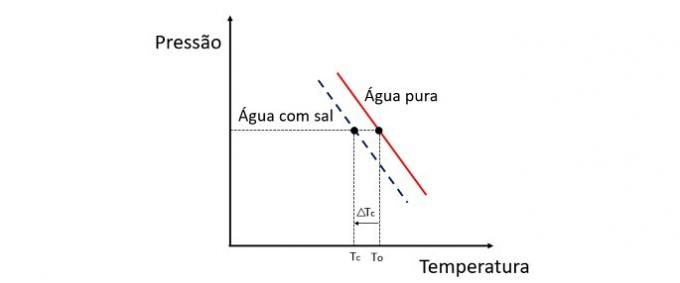
Η προσθήκη διαλυτής στο νερό μειώνει τη θερμοκρασία ψύξης. Ως εκ τούτου, το απλό νερό τείνει να παγώνει πολύ πιο γρήγορα από ένα διάλυμα αλατιού και νερού όταν εκτίθεται στις ίδιες συνθήκες.
Εξήγηση
Η κρυοσκόπηση είναι μια συνεργική ιδιότητα που μελετά τη διακύμανση της θερμοκρασίας ενός διαλύτη όταν διαλύονται διαφορετικές ποσότητες διαλυμένης ουσίας.
Η μείωση της θερμοκρασίας ψύξης του νερού προκαλείται από μια μη πτητική διαλυμένη ουσία και αυτό το φαινόμενο έχει πολλές πρακτικές εφαρμογές. Επομένως, όσο μεγαλύτερη είναι η συγκέντρωση της διαλυμένης ουσίας στο διάλυμα επηρεάζει το κρυοσκοπικό αποτέλεσμα.
Εάν, για παράδειγμα, το νερό παγώσει στους 0 ° C και προσθέσουμε αλάτι σε αυτό, η θερμοκρασία αλλαγής φάσης θα είναι αρνητική, δηλαδή πολύ χαμηλότερη.
Γι 'αυτό το νερό της θάλασσας δεν παγώνει σε μέρη των οποίων η θερμοκρασία είναι κάτω από 0 ° C. Το αλάτι που διαλύεται σε νερό τείνει να μειώσει περαιτέρω τη θερμοκρασία κατάψυξης. Σε μέρη όπου υπάρχει χιόνι, είναι επίσης συνηθισμένο να ρίχνετε αλάτι στους δρόμους για να λιώσετε τον πάγο και να αποφύγετε ατυχήματα.
Μάθε περισσότερα για συνεργατικές ιδιότητες.
4ο πείραμα - αποσύνθεση υπεροξειδίου του υδρογόνου
έννοιες που εμπλέκονται: χημική αντίδραση και καταλύτης
Υλικά
- Μισή ωμή πατάτα και μισή μαγειρεμένη
- Ένα κομμάτι ωμό συκώτι και ένα άλλο μαγειρεμένο κομμάτι
- Υπεροξείδιο του υδρογόνου
- 2 πιάτα
Πως να φτιάξεις
- Σε κάθε πιάτο προσθέστε φαγητό, πατάτες μαζί και συκώτι μαζί.
- Σε καθένα από τα τέσσερα υλικά προσθέστε 3 σταγόνες υπεροξειδίου του υδρογόνου.
- Παρακολουθήστε τι συμβαίνει και συγκρίνετε τα αποτελέσματα.
Αποτέλεσμα
Το υπεροξείδιο του υδρογόνου, ένα διάλυμα υπεροξειδίου του υδρογόνου, όταν έρχεται σε επαφή με ωμά τρόφιμα, αρχίζει να αναβράζει σχεδόν αμέσως.
Αυτό το πείραμα μπορεί επίσης να γίνει προσθέτοντας ένα κομμάτι τροφής σε ένα δοχείο με υπεροξείδιο του υδρογόνου για να κάνει την αντίδραση πιο αισθητή.
Εξήγηση
Ο αναβρασμός που παρουσιάζεται από το υπεροξείδιο του υδρογόνου όταν έρχεται σε επαφή με ωμά τρόφιμα χαρακτηρίζει το εμφάνιση χημικής αντίδρασης, η οποία είναι η αποσύνθεση του υπεροξειδίου του υδρογόνου και η απελευθέρωση του αερίου οξυγόνο.
Η αποσύνθεση του υπεροξειδίου του υδρογόνου λαμβάνει χώρα μέσω της δράσης του ενζύμου καταλάσης, που βρίσκεται στα οργανικά υπεροξυσώματα, που υπάρχουν σε ζωικά και φυτικά κύτταρα.
Είναι σημαντικό να σημειωθεί ότι η αποσύνθεση του υπεροξειδίου του υδρογόνου συμβαίνει αυθόρμητα, παρουσία ηλιακού φωτός, αλλά σε πολύ αργή αντίδραση. Ωστόσο, η καταλάση δρα ως καταλύτης, αυξάνοντας την ταχύτητα της χημικής αντίδρασης.
Το υπεροξείδιο του υδρογόνου μπορεί να είναι μια τοξική ουσία στα κύτταρα. Επομένως, η καταλάση διασπά την ένωση και παράγει νερό και οξυγόνο, δύο ουσίες που δεν βλάπτουν το σώμα.
Όταν μαγειρεύεται το φαγητό, τα συστατικά του υφίστανται αλλαγές. Οι τροποποιήσεις που προκαλούνται από το μαγείρεμα επίσης θέτουν σε κίνδυνο τη δράση της καταλάσης με μετουσίωση της πρωτεΐνης.
Η ίδια δράση που βλέπουμε με τα τρόφιμα είναι αυτό που συμβαίνει όταν βάζουμε υπεροξείδιο του υδρογόνου σε μια πληγή. Η καταλάση δρα και υπάρχει ο σχηματισμός φυσαλίδων, που συνίσταται στην απελευθέρωση οξυγόνου.
Μάθε περισσότερα για χημικές αντιδράσεις.
Βιβλιογραφικές αναφορές
Άγιοι, W. ΜΕΓΑΛΟ. Π.; MOL, Γ. ΜΙΚΡΟ. (Κορδόνια.). Χημεία Πολιτών. 1. εκδ. Σάο Πάολο: Νέα γενιά, 2011. β. 1, 2, 3.
ΒΡΑΖΙΛΙΑ ΧΗΜΙΚΗ ΚΟΙΝΩΝΙΑ (οργ.) 2010. Χημεία κοντά σας: Πειράματα χαμηλού κόστους για την τάξη K-12. 1. εκδ. Σάο Πάολο.


