Διανομή ηλεκτρονίων ή διαμόρφωση ηλεκτρονίων με τον τρόπο ταξινόμησης των χημικών στοιχείων λαμβάνοντας υπόψη τον αριθμό των ηλεκτρονίων που έχουν και την εγγύτητά τους στον ατομικό πυρήνα.
Ηλεκτρονική κλιμακωτή διανομή
Αφού εμφανίστηκαν αρκετά ατομικά μοντέλα, το μοντέλο Bohr πρότεινε την οργάνωση της ηλεκτροσφαίρας σε τροχιές.
Τα ηλεκτρόνια οργανώνονται και κατανέμονται μέσω των ηλεκτρονικών στρωμάτων, μερικά είναι πιο κοντά στον πυρήνα και άλλα πιο μακριά.
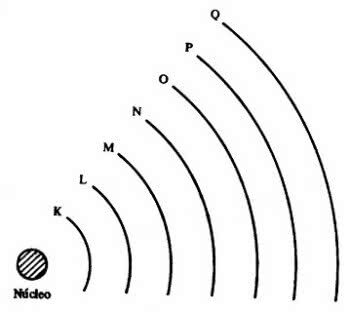
Έπειτα ήρθαν τα 7 ηλεκτρονικά στρώματα (K, L, M, N, O, P και Q), τα οποία αντιπροσωπεύονται από τις οριζόντιες γραμμές με αριθμό 1 έως 7 στον περιοδικό πίνακα.
Τα στοιχεία στις ίδιες γραμμές έχουν τον ίδιο μέγιστο αριθμό ηλεκτρονίων και επίσης τα ίδια επίπεδα ενέργειας.
Έτσι, είναι δυνατόν να παρατηρήσουμε ότι τα ηλεκτρόνια βρίσκονται σε επίπεδα ενέργειας και υπο-επίπεδα. Έτσι ο καθένας έχει μια ορισμένη ποσότητα ενέργειας.
|
Επίπεδο ενέργειας |
Ηλεκτρονικό στρώμα |
Μέγιστος αριθμός ηλεκτρονίων |
|---|---|---|
| 1° | κ | 2 |
| 2° | μεγάλο | 8 |
| 3° | Μ | 18 |
| 4° | Ν | 32 |
| 5° | Ο | 32 |
| 6° | Π | 18 |
| 7° | Ερ | 8 |
Ο στρώμα σθένους είναι το τελευταίο ηλεκτρονικό στρώμα, δηλαδή το εξώτατο στρώμα του ατόμου. Σύμφωνα με Κανόνας Octet, τα άτομα έχουν την τάση να σταθεροποιούνται και να γίνονται ουδέτερα.
Αυτό συμβαίνει όταν έχουν την ίδια ποσότητα πρωτονίων και νετρονίων, με οκτώ ηλεκτρόνια στο τελευταίο κέλυφος ηλεκτρονίων.
Αργότερα, εμφανίστηκαν τα ενεργειακά υποστρώματα, που αντιπροσωπεύονται από τα πεζά γράμματα s, p, d, f Κάθε υπόστρωμα υποστηρίζει μέγιστο αριθμό ηλεκτρονίων:
| δευτερεύοντα επίπεδα | Μέγιστος αριθμός ηλεκτρονίων |
|---|---|
| μικρό | 2 |
| Π | 6 |
| ρε | 10 |
| φά | 14 |
Διάγραμμα Pauling
Ο Αμερικανός χημικός Linus Carl Pauling (1901-1994) μελέτησε ατομικές δομές και ανέπτυξε ένα σχήμα που εξακολουθεί να χρησιμοποιείται σήμερα.
Ο Pauling βρήκε έναν τρόπο να βάλει όλα τα επίπεδα ενέργειας σε αύξουσα σειρά, χρησιμοποιώντας τη διαγώνια κατεύθυνση. Το σχήμα έγινε γνωστό ως Διάγραμμα Pauling.
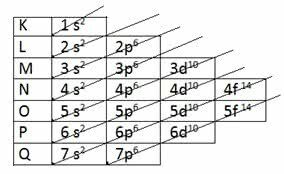
Αύξουσα σειρά: 1δ2 2δ2 2ρ6 3δ2 3ρ6 4δ2 3δ10 4ρ6 5 δευτ2 4δ10 5ρ6 6δ2 4στ14 5δ10 6ρ6 7 δευτ2 5στ14 6δ10 7ρ6
Σημειώστε ότι ο αριθμός που υποδεικνύεται μπροστά από το ενεργειακό υπόγειο αντιστοιχεί στο επίπεδο ενέργειας.
Για παράδειγμα, σε 1s2:
- μικρό υποδηλώνει το επίπεδο ενέργειας
- 1 δείχνει το πρώτο επίπεδο, που βρίσκεται στο επίπεδο Κ
- εκθέτης 2 υποδεικνύει τον αριθμό των ηλεκτρονίων σε αυτό το επίπεδο
Πώς να κάνετε ηλεκτρονική διανομή;
Για να κατανοήσετε καλύτερα τη διαδικασία ηλεκτρονικής διανομής, δείτε την λύση που ακολουθεί παρακάτω.
1. Κάντε την ηλεκτρονική διανομή του στοιχείου Iron (Fe) που έχει ατομικό αριθμό 26 (Z = 26):
Κατά την εφαρμογή του διαγράμματος Linus Pauling, οι διαγώνιες διασχίζονται προς την κατεύθυνση που υποδεικνύεται στο μοντέλο. Τα ενεργειακά επίπεδα είναι γεμάτα με τον μέγιστο αριθμό ηλεκτρονίων ανά κέλυφος ηλεκτρονίων, μέχρι την ολοκλήρωση των 26 ηλεκτρονίων του στοιχείου.
Για να κάνετε τη διανομή, δώστε προσοχή στον συνολικό αριθμό ηλεκτρονίων σε κάθε επίπεδο και στα αντίστοιχα ηλεκτρονικά στρώματα:
Κ - δ2
L - 2δ2 2ρ6
Μ - 3δ2 3ρ6 3δ10
Ν - 4δ2
Σημειώστε ότι δεν ήταν απαραίτητο να κάνετε την ηλεκτρονική διανομή σε όλα τα επίπεδα, καθώς ο ατομικός αριθμός σιδήρου είναι 26.
Έτσι, η ηλεκτρονική διανομή αυτού του στοιχείου παρουσιάζεται ως εξής: 1s2 2δ2 2ρ6 3δ2 3ρ6 4δ2 3δ6. Το άθροισμα των εκθετικών αριθμών ανέρχεται σε 26, δηλαδή, ο συνολικός αριθμός ηλεκτρονίων που υπάρχουν στο άτομο σιδήρου.
Εάν η ηλεκτρονική διανομή υποδεικνύεται από στρώματα, παρουσιάζεται ως εξής: K = 2; L = 8; Μ = 14; Ν = 2.
Αξιοποιήστε την ευκαιρία για να δοκιμάσετε τις γνώσεις σας Ασκήσεις ηλεκτρονικής διανομής.
Στο Περιοδικός Πίνακας, φαίνεται ως εξής:

Διαβάστε επίσης:
- Ηλεκτρονική συγγένεια
- Κβαντικοί αριθμοί
- Ασκήσεις στον περιοδικό πίνακα
- Ασκήσεις για την οργάνωση του περιοδικού πίνακα