Ο ιονικός διαχωρισμός είναι ο διαχωρισμός των ιόντων που συμβαίνει από τις ιοντικές ενώσεις που διαλύονται στο νερό.
Το νερό αλληλεπιδρά με τα ιόντα και προκαλεί το διαχωρισμό τους, ένα φαινόμενο που ονομάζεται διαλυτοποίηση.
Η διαδικασία διαχωρισμού ανακαλύφθηκε από τον φυσικό-χημικό Svant August Arrhenius (1859-1927).
Σημείωσε ότι ορισμένες ουσίες όταν τοποθετούνται στο νερό θα μπορούσαν να μεταφέρουν ηλεκτρισμό. Έτσι, ο Arrhenius πρότεινε ότι σε υδατικά διαλύματα πρέπει να υπάρχουν ηλεκτρικά φορτισμένα σωματίδια, τα ιόντα.
Είναι σημαντικό να τονιστεί ότι μόνο ιοντικές ουσίες, όπως άλατα και βάσεις, υφίστανται διαχωρισμό όταν βρίσκονται σε διαλύματα ή λιώνουν.
Επεξεργάζομαι, διαδικασία
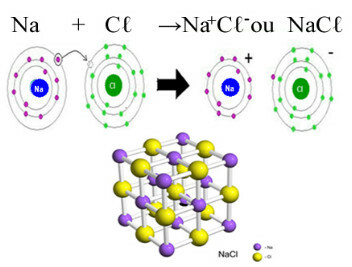
Για παράδειγμα, η διαδικασία διαχωρισμού, μπορούμε να χρησιμοποιήσουμε NaCl, επιτραπέζιο αλάτι.
Όταν το NaCl τοποθετείται σε νερό, έχουμε την ακόλουθη εξίσωση:
Το NaCl είναι μια ιοντική ένωση, έτσι τα ιόντα υπήρχαν ήδη, αυτό που συνέβη μόνο ήταν ο διαχωρισμός μεταξύ τους μέσω της δράσης του νερού.
Τώρα έχουμε ένα άλλο παράδειγμα χρησιμοποιώντας μια βάση:
Το NaOH, μια βάση, όταν τοποθετείται σε νερό, ο δεσμός μεταξύ του Na+ και ω- είναι σπασμένο και απελευθερώνονται στη μέση.
Να θυμάστε ότι οι βάσεις είναι ουσίες που απελευθερώνουν ιόντα υδροξυλίου (ανιόντα ΟΗ–) σε υδατικό διάλυμα.
Άλλα παραδείγματα ιοντικής διάστασης σε βάσεις:
1)
2)
Το σημαντικό είναι ότι τα ελεύθερα ιόντα σε υδατικά διαλύματα μπορούν να παράγουν ηλεκτρισμό.
Διαβάστε επίσης:
- άλατα
- Βάσεις
- Αντίδραση εξουδετέρωσης
Διαχωρισμός και ιονισμός
Κατανοήστε τη διαφορά μεταξύ ιοντικής διάστασης και ιονισμός:
- ιοντική διάσταση: Είναι η φυσική διαδικασία διαχωρισμού ιόντων που λαμβάνει χώρα σε άλατα και βάσεις.
- ιονισμός: Είναι μια χημική αντίδραση που προέρχεται ιόντα από οξέα που τοποθετούνται στο νερό.
Έτσι, ο ιονισμός είναι η διαδικασία σχηματισμού ιόντων. Παράδειγμα:
Στην περίπτωση του HCl (υδροχλωρικό οξύ), ο χημικός δεσμός μεταξύ Η και Cl διασπάται και σχηματίζονται ιόντα Η+ και Cl-.
Τα κοινά, σε διαχωρισμό και ιονισμό, τα ηλεκτρόνια μπορούν να μεταφέρουν ηλεκτρισμό.

Αυτή η κατάσταση δεν συμβαίνει, για παράδειγμα, με ζάχαρη (C12Η22Ο11) που δεν σχηματίζει ιόντα σε υδατικό διάλυμα.
Επομένως, δεν υπάρχει αγωγιμότητα ηλεκτρικής ενέργειας και η ζάχαρη διαλύεται στο νερό.
Μάθετε περισσότερα, διαβάστε επίσης:
- ιόν, κατιόν και ανιόν
- ιοντική ισορροπία
- Χημικοί δεσμοί
- Φυσικοί και χημικοί μετασχηματισμοί
Φροντίστε να ελέγξετε τις ερωτήσεις για τις εισαγωγικές εξετάσεις σχετικά με το θέμα, με ψήφισμα με σχόλια, σε: ασκήσεις σε ανόργανες λειτουργίες.