Η αλλοτροπία είναι ένα φαινόμενο που συμβαίνει όταν το ίδιο χημικό στοιχείο έχει την ιδιότητα να σχηματίζει περισσότερες από μία απλές ουσίες.. Αυτές οι αλλοτροπικές ποικιλίες μπορεί να διαφέρουν λόγω του αριθμού των ατόμων του στοιχείου που συνδέονται μεταξύ τους σε ένα μόριο ή λόγω της διάταξης των ατόμων στο κρυσταλλικό πλέγμα.
Ένα από τα στοιχεία που έχουν αλλοτροπικές ποικιλίες είναι ο φώσφορος (P), με τα πιο κοινά να είναι το λευκό φωσφόρο είναι το ερυθρός φωσφόρος. Αυτά τα δύο αλλοτρόπα φωσφόρου διαφέρουν όχι από τη διαφορετική χωρική τους διάταξη, καθώς και τα δύο βασικά αποτελούνται από τετραεδρικά μόρια, αλλά η ποσότητα των ατόμων φωσφόρου είναι διαφορετική σε κάθε ένα.
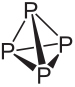
Δείτε τη σύσταση και τα κύρια χαρακτηριστικά του λευκού και του κόκκινου φωσφόρου:
- Λευκός Φώσφορος:
Ο μοριακός τύπος του λευκού φωσφόρου είναι Π4, που σημαίνει ότι τα μόριά του αποτελούνται από τέσσερα άτομα φωσφόρου.

Αυτός ο τύπος φωσφόρου είναι εξαιρετικά αντιδραστικός, κυρίως λόγω της έντασης στις γωνίες 60 ° μεταξύ των δεσμών του. Είναι τόσο αντιδραστικό που πρέπει να αποθηκευτεί σε νερό, ώστε να μην έρθει σε επαφή με τον αέρα και να εκραγεί. Πρέπει να προσέχετε ιδιαίτερα όταν το χειρίζεστε, καθώς προκαλεί σοβαρά εγκαύματα στο δέρμα και δηλητηρίαση σε περίπτωση κατάποσης (μόλις 0,1 g λευκού φωσφόρου που λαμβάνεται μπορεί να οδηγήσει σε θάνατο).
Όπως μπορείτε να δείτε παρακάτω, ο λευκός φωσφόρος είναι ένα λευκό στερεό που μοιάζει με κερί.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)

Λευκός φώσφορος αποθηκευμένος στο νερό για να μην έρθει σε επαφή με τον αέρα *
Εάν θερμανθεί απουσία αέρα, ο λευκός φωσφόρος μετατρέπεται σε κόκκινο φωσφόρο.
- ερυθρός φωσφόρος:
Ο κόκκινος φωσφόρος δεν έχει καθορισμένη δομή, αλλά υπάρχουν ενδείξεις ότι είναι μακρομόρια που σχηματίζονται από τη σύνδεση των αναφερθέντων τετραεδρικών δομών (Ρ4), εκπροσωπούμενη από τον Πόχι.
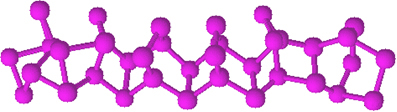
Είναι πολύ λιγότερο αντιδραστικό από το λευκό φωσφόρο, ωστόσο, μπορεί να αναφλεγεί εάν τρίβεται. Γι 'αυτό χρησιμοποιείται στις πλαϊνές επιφάνειες των κουτιών αντιστοίχισης. Όταν τρίβουμε την οδοντογλυφίδα στην επιφάνεια του κουτιού, το σπίρτο αναφλέγεται και, με τη σειρά του, αναφλέγει το εξαιρετικά εύφλεκτο υλικό στο κεφάλι της οδοντογλυφίδας.
Σε ορισμένες χώρες, ο αγώνας τοποθετείται στο κεφάλι της οδοντογλυφίδας με τη μορφή P.4μικρό3.
Ο κόκκινος φωσφόρος είναι μια άμορφη σκόνη, δηλαδή, δεν έχει κρυσταλλική δομή και έχει σκούρο κόκκινο χρώμα, όπως φαίνεται παρακάτω:

Κόκκινη σκόνη φωσφόρου.
* Η συγγραφή εικόνων ανήκει στον W. Oelen και αυτή μπορεί να βρεθεί εδώ.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αλλοτροπία φωσφόρου"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Χημεία
Τι είναι αλλοτροπία, απλές ουσίες, αέριο οξυγόνο, όζον, αλλοτροπικές μορφές, χημικό στοιχείο οξυγόνο, υπεριώδεις ακτίνες από τον ήλιο, διαμάντι, γραφίτης, ατομικότητα, λευκός φωσφόρος.