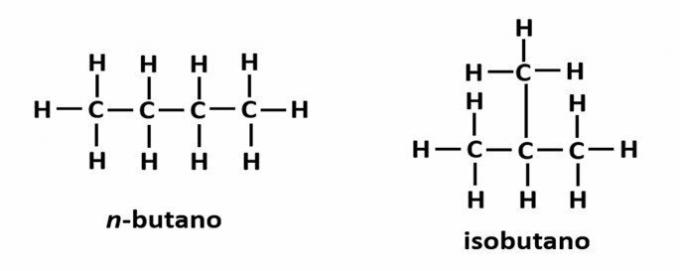
Οι οργανικές ενώσεις μπορούν να αναπαρασταθούν με διάφορους τρόπους, όπως μια επίπεδη δομική φόρμουλα, ένας απλοποιημένος ή συμπυκνωμένος συντακτικός τύπος ή ένας τύπος παύλας. Ωστόσο, η απλούστερη αναπαράσταση είναι μέσω του μοριακού τύπου.

Έτσι, ας δούμε πώς να προσδιορίσουμε τον μοριακό τύπο οργανικών ενώσεων, με βάση τους άλλους τύπους που αναφέρονται παραπάνω.
1. Μέσα από το επίπεδο δομικό τύπο:Αυτός ο τύπος δείχνει τη διάταξη ή διάταξη ατόμων εντός του μορίου. Για παράδειγμα, παρακάτω είναι η επίπεδη δομική φόρμουλα ενός από τους υδρογονάνθρακες που υπάρχουν στη βενζίνη.

Σημειώστε ότι, σε αυτόν τον τύπο, εμφανίζονται όλα τα άτομα και όλοι οι υπάρχοντες δεσμοί μεταξύ τους. Τώρα, για να προσδιορίσετε τον μοριακό τύπο αυτής της ένωσης, μετρήστε απλώς τον αριθμό των ατόμων κάθε στοιχείου και τοποθετήστε έναν δείκτη στην κάτω δεξιά πλευρά του εν λόγω στοιχείου.
Μια σημαντική πτυχή που πρέπει να επισημανθεί είναι ότι ξεκινάμε πάντα τον μοριακό τύπο οργανικών ενώσεων από το στοιχείο άνθρακας, καθώς είναι το κύριο συστατικό αυτών των ουσιών. Δείτε το παράδειγμα:
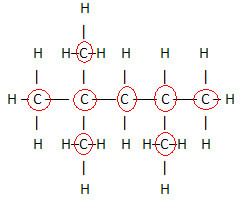
Δεδομένου ότι υπάρχουν 8 άνθρακες, αρχίζουμε να γράφουμε τον μοριακό τύπο ως εξής: ΝΤΟ8
Για να συμπληρώσουμε αυτόν τον τύπο, μετράμε την ποσότητα των υδρογόνων:
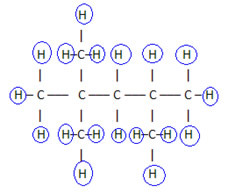
Λοιπόν σας μοριακός τύπος é ΝΤΟ8Η18.
2. Μέσω του απλοποιημένου ή συμπυκνωμένου δομικού τύπου: Σε αυτόν τον τύπο τύπου, η ποσότητα των υδρογόνων συντομεύεται. Για παράδειγμα, δείτε τον ίδιο τύπο για το μόριο που βρίσκεται στη βενζίνη, τώρα σε συμπυκνωμένη μορφή:
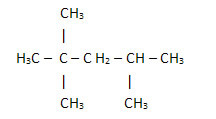
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Με αυτόν τον τρόπο είναι ακόμη πιο εύκολο να μετρήσετε την ποσότητα των υδρογόνων, απλώς προσθέστε τους δείκτες (3 +3+ 3 +2 +1 +3 +3 = 18).
Αλλά τώρα ας δούμε τη συμπυκνωμένη δομική φόρμουλα του λινελαϊκού οξέος, η οποία υπάρχει σε λαχανικά όπως βαμβάκι, σόγια, ηλιοτρόπια κ.λπ. και το οποίο χρησιμοποιείται σε χρώματα και βερνίκια:
Η3C─CH2Χ.Χ.2Χ.Χ.2Χ.Χ.2CH═CH─CH2CH═CH─CH2Χ.Χ.2Χ.Χ.2Χ.Χ.2Χ.Χ.2Χ.Χ.2Χ.Χ.2─COOH
Μετρώντας την ποσότητα άνθρακα, υδρογόνων και οξυγόνων, έχουμε τα ακόλουθα μοριακός τύπος λινελαϊκού οξέος: ΝΤΟ18Η32Ο2.
3. Μέσω του τύπου εγκεφαλικού επεισοδίου: Αυτός ο τύπος απλοποιεί περαιτέρω τον τρόπο αναπαραγωγής οργανικών ενώσεων, καθώς παραλείπει τις ομάδες C, CH, CH2 και CH3.
Ένα παράδειγμα είναι το λινολεϊκό μόριο, δείτε πώς φαίνεται:

Ας μετρήσουμε πρώτα την ποσότητα των άνθρακα, θυμόμαστε ότι, σε αυτόν τον τύπο, κάθε δεσμός μεταξύ των ανθράκων αντιπροσωπεύεται από την παύλα. Έτσι, οι άκρες, καθώς και τα δύο σημεία καμπής, αντιστοιχούν σε άτομα άνθρακα.
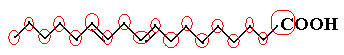
Έχουμε λοιπόν: ΝΤΟ18
Τώρα, για να μετρήσουμε την ποσότητα των υδρογόνων, πρέπει να θυμόμαστε ότι οι δεσμοί μεταξύ άνθρακα και υδρογόνων υπονοούνται, καθώς ο άνθρακας είναι γνωστό ότι δημιουργεί τέσσερις δεσμούς. Έτσι, η ποσότητα δεσμών που λείπουν είναι η ποσότητα υδρογόνου που συνδέεται με αυτό το στοιχείο.
Δείτε τις εξηγήσεις παρακάτω:
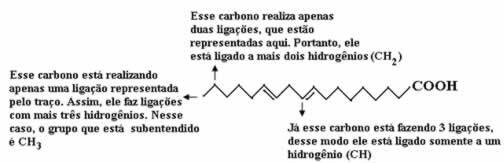
Έτσι, η ποσότητα των υδρογόνων θα είναι: 32.

Η ποσότητα οξυγόνου είναι αρκετά απλή για να μετρηθεί, καθώς υπάρχουν μόνο δύο. Από το μοριακός τύπος é: ΝΤΟ18Η32Ο2.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Μοριακοί τύποι οργανικών ενώσεων" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Χωρικός τύπος Carbon, ηλεκτρονικός τύπος Lewis, δομή επιπέδου, ηλεκτρονικά ζεύγη, δεσμός ομοιοπολικό, στρώμα σθένους, εξέλιξη του ατομικού μοντέλου, μοριακός τύπος, δομικός τύπος, τύποι τρισδιάστατο.
Χημικοί τύποι, επίπεδος δομικός τύπος, συντακτικός τύπος Couper, τριπλός δεσμός, αέριο άζωτο, ηλεκτρονικός τύπος, τύπος Lewis, μοριακός τύπος, μονός δεσμός, διπλός δεσμός, αέριο ανθρακικός.