Εσείς Υδρογονάνθρακες αποτελούνται από την άνθρακας (Γ) και υδρογόνο (Η). Η ευελιξία του άνθρακα, που είναι το κύριο στοιχείο αυτών των ενώσεων, ευνοεί την ύπαρξη μιας τεράστιας ποικιλίας δομών Επομένως, ορισμένες ιδιότητες, όπως το σημείο τήξης και το σημείο βρασμού, μπορεί να διαφέρουν μεταξύ ενός υδρογονάνθρακα και ενός άλλου.
Είναι κυρίως μόρια απολόος, με δύναμημικρό διαμοριακό προκαλούμενο δίπολο τύπου και πυκνότητα μικρότερη από ο από το νερό. Η ταυτοποίηση αυτών των ενώσεων μπορεί να γίνει μέσω της ονοματολογίας, η οποία ακολουθεί τους κανόνες που έχουν θεσπιστεί από τη Διεθνή Ένωση της Καθαρής και Εφαρμοσμένης Χημείας (Iupac).
Διαβάστε επίσης: Άνθρακας - ένα από τα πιο άφθονα στοιχεία στο Σύμπαν
Ιδιότητες υδρογονανθράκων

Πόλωση: οι υδρογονάνθρακες χωρίς την παρουσία ετεροατόμων είναι απολόος.
Διαμοριακές δυνάμεις: οι δεσμοί μεταξύ των μορίων ενός υδρογονάνθρακα είναι του τύπου διπολικό που προκαλείται.
σημείο τήξεως και καιβρασμός: ποικίλλουν ανάλογα με το μέγεθος, τη λειτουργία και τη δομική οργάνωση του μορίου.
φυσική κατάσταση: υπό κανονικές συνθήκες θερμοκρασίας και πίεσης, οι υδρογονάνθρακες με τέσσερα ή λιγότερα άτομα άνθρακα βρίσκονται σε αέρια κατάσταση. Εκείνοι με 5 έως 17 άνθρακες βρίσκονται σε υγρή κατάσταση και οι υδρογονάνθρακες με περισσότερους από 17 άνθρακες είναι στερεές ουσίες.
Πυκνότητα: είναι μικρότερο από το πυκνότητα νερού, δηλαδή λιγότερο από 1,0 g / cm³.
Αντιδραστικότητα: οι αλειφατικοί και ακόρεστοι υδρογονάνθρακες είναι ελάχιστα αντιδραστικοί. ακόρεστες ενώσεις είναι πιο πιθανό να αντιδράσουν με άλλα μόρια και οι κυκλικοί υδρογονάνθρακες με έως και πέντε άνθρακες είναι πολύ αντιδραστικοί.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Ταξινόμηση υδρογονανθράκων
Οι υδρογονάνθρακες μπορεί να ταξινομηθεί από τη δομική οργάνωση της αλυσίδας και από τα ιδρύματα.Ακορεσμός είναι η παρουσία διπλού ή τριπλού δεσμού μεταξύ άνθρακα, είναι η εμφάνιση του συνδέσεις τύπου pi (π). ήδη το κλαδια δεντρου Είναι σαν «κλάδοι» που συνδέονται με μια μεγαλύτερη δομή υδρογονανθράκων. Οι κυκλικές αλυσίδες μπορούν επίσης να περιέχουν κλαδιά ή / και ακόρεστα - η δομική οργάνωση των υδρογονανθράκων κλειστής αλυσίδας σχηματίζει πολύγωνα όπως τετράγωνο, τρίγωνο, εξάνιο, μεταξύ άλλων.
Όσον αφορά τη διάταξη των ατόμων, ένας υδρογονάνθρακας μπορεί να έχει μια φυσιολογική ή διακλαδισμένη αλυσίδα.
→ C υδρογονάνθρακαςκανονική, γραμμική ή ευθεία γραμμή: αυτό με μια συμβολοσειρά που έχει μόνο δύο άκρα.

→ C υδρογονάνθρακαςμισεί κλαδωτός: το ένα με μια αλυσίδα που έχει περισσότερα από δύο άκρα. Για να μάθετε πού και ποια είναι τα κλαδιά, είναι σημαντικό να επιλέξετε σωστά την κύρια αλυσίδα. Η κύρια αλυσίδα πρέπει να περιέχει όλους τους ακόρεστους και ετεροάτομα (εάν υπάρχουν), καθώς ο μεγαλύτερος αριθμός διαδοχικών άνθρακα. Οι άνθρακες που δεν περιέχονται στην κύρια αλυσίδα είναι κλάδοι.
Παράδειγμα:

Όσον αφορά το «κλείσιμο» του, ένας υδρογονάνθρακας μπορεί να έχει κλειστή, ανοιχτή ή μικτή αλυσίδα.
→ Αλυσίδα υδρογονανθράκωνμικρό κλειστό ή κυκλικό: αυτές με αλυσίδες στις οποίες τα άτομα οργανώνονται σχηματίζοντας κύκλο, πολύγωνο ή αρωματικό δακτύλιο (κλειστός υδρογονάνθρακας με εναλλασσόμενους ακόρεστους). Μην έχετε χαλαρά άκρα εκτός εάν υπάρχει κλαδί. Κάθε κορυφή του πολυγώνου αντιπροσωπεύει έναν άνθρακα και τους αντίστοιχους παράγοντες σύνδεσης υδρογόνου.
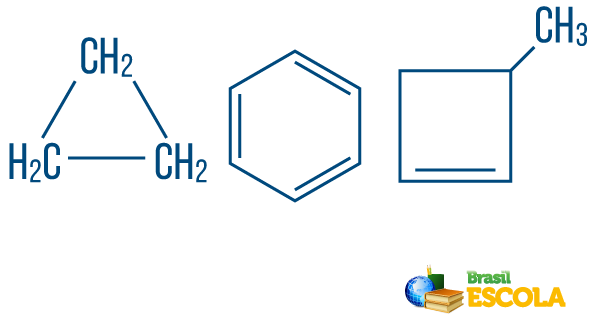
→ Ανοικτή αλυσίδα ή ακυκλικοί υδρογονάνθρακες: είναι αυτές με αλυσίδες που έχουν τουλάχιστον δύο άκρα.

→ Υδρογονάνθρακας συμβολοσειρά μικτού τύπου: σχηματίζεται από δακτύλιο ή κυκλική αλυσίδα που συνδέεται με γραμμικό μέρος έχει τουλάχιστον ένα άκρο.
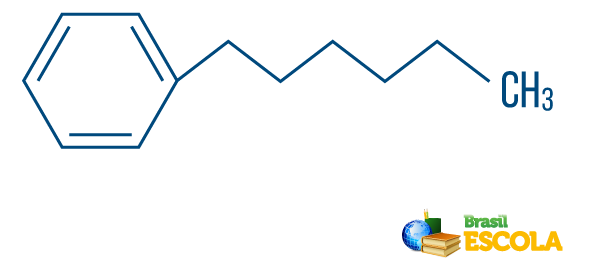
Διαβάστε επίσης: Αρωματικοί υδρογονάνθρακες - παραδείγματα και ιδιότητες
Ονοματολογία υδρογονανθράκων
Για κάθε τύπο υδρογονάνθρακα, υπάρχει ένας κανόνας ονομασίας που θεσπίστηκε από την Iupac. Η ονοματολογία αυτών των ενώσεων γίνεται ως εξής:
1ο μέρος: τοποθεσία και όνομα υποκαταστήματος (εάν υπάρχουν) ·
2ο μέρος: ισχύει ο όρος κύκλος εάν η ένωση είναι κλειστή αλυσίδα, αλλά εάν είναι αλειφατική (ανοιχτή) αλυσίδα, δεν θα είναι απαραίτητη.
3ο μέρος: πρόθεμα που δείχνει πόσους άνθρακες υπάρχουν στην κύρια αλυσίδα.
4ο μέρος: θέση και έγχυση ενδεικτικό του τύπου ακόρεστου στο μόριο.
5ο μέρος: επίθημα "o" κατάλληλο για υδρογονάνθρακες.
Εάν το μόριο έχει ανοιχτή δομή, χωρίς διακλάδωση, η ονοματολογία θα ξεκινήσει στο μέρος 3.
Ο παρακάτω πίνακας δείχνει τις απαιτούμενες πληροφορίες (πρόθεμα, επίθημα και επίθημα) για την ονοματολογία υδρογονανθράκων γενικά. Ο πρόθεμα ποικίλλει ανάλογα με τον αριθμό των ανθράκων · Ο εμπήγω, ανάλογα με τον αριθμό των ακόρεστων · είναι το κατάληξη“Ο " αναφέρεται σε ενώσεις του τύπου υδρογονανθράκων.
Πρόθεμα |
Εμπήγω |
Κατάληξη |
||
1 άνθρακας |
συνάντησε- |
Μόνο μεμονωμένες κλήσεις |
-ένα- |
-Ο |
2 άνθρακες |
et- |
|||
3 άνθρακες |
στήριγμα- |
1 διπλός δεσμός |
-εν- |
|
4 άνθρακες |
αλλά- |
|||
5 άνθρακες |
έγκλειστος- |
2 διπλοί δεσμοί |
-αδέν- |
|
6 άνθρακες |
μαγεύω- |
|||
7 άνθρακες |
επτά- |
1 τριπλός δεσμός |
-σε- |
|
8 άνθρακες |
οκτ- |
|||
9 άνθρακες |
μη- |
2 τριπλοί σύνδεσμοι |
-διενέργεια- |
|
10 άνθρακες |
Δεκ- |
Το πρώτο βήμα για την ανακάλυψη της ονοματολογίας μιας οργανικής ένωσης είναι προσδιορίστε την κύρια αλυσίδα άνθρακα, που πρέπει να περιέχει τους ακόρεστους και όσο το δυνατόν περισσότερους διαδοχικούς άνθρακες. Μετά τον προσδιορισμό της κύριας αλυσίδας, το οι άνθρακες πρέπει να απαριθμηθούν - έναρξη της μέτρησης από την πλησιέστερη πλευρά στα κλαδιά και ακόρεστους (εάν υπάρχουν). Ο εντοπισμός θα είναι ο αριθμός του άνθρακα όπου βρίσκεται ο κλάδος ή ακόρεστος. Μερικές φορές υπάρχει μόνο μία πιθανή τοποθεσία για έναν ριζικό ή διπλό ή τριπλό δεσμό, οπότε δεν είναι απαραίτητο να εκφράζεται η θέση του συνδετικού άνθρακα στην ονοματολογία.

Ο ονοματολογία για υποκαταστήματα θα δοθεί από τον αριθμό των ανθράκων σε καθένα, συν τον τερματισμό γραμμή ή θα είμαι. Όταν υπάρχουν περισσότεροι από ένας κλάδοι, χρησιμοποιείται αλφαβητική σειρά.
Δείτε τα ακόλουθα παραδείγματα:
→ Παράδειγμα 1
Χ.Χ.3 - CH2 - CH3 → Προπάνιο
1ο μέρος: το πρόθεμα «στήριγμα-"Υποδεικνύει ότι η αλυσίδα έχει τρεις άνθρακες.
2ο μέρος: το infix "-ένα-»Σηματοδοτεί ότι το μόριο κάνει συνδέσεις μόνο του τύπου σίγμα ή απλό.
3ο μέρος: το επίθημα "-ΟΕίναι χαρακτηριστικό των υδρογονανθράκων.
→ Παράδειγμα 2
Χ.Χ.2= CH-CH2-CH3 → Όμως-1-ene
Σε υδρογονάνθρακες με ακόρεστο, είναι απαραίτητη η αρίθμηση και ο εντοπισμός του άνθρακα στον οποίο βρίσκεται το ζεύγος και η αρίθμηση πρέπει να είναι όσο το δυνατόν μικρότερη. Για αυτό, η μέτρηση του άνθρακα πρέπει να ξεκινά με την πλευρά που βρίσκεται πλησιέστερα στον διπλό δεσμό.
1ο μέρος: "αλλά-" δείχνει ότι υπάρχουν τέσσερις άνθρακες στην αλυσίδα.
2ο μέρος: "1-el" αναφέρεται στον ακόρεστο που βρίσκεται μεταξύ του άνθρακα 1 και 2.
3ο μέρος: "-Ο" είναι το χαρακτηριστικό επίθημα των υδρογονανθράκων.
→ Παράδειγμα 3

1ο μέρος: "3-αιθυλ" σηματοδοτεί ότι υπάρχει ένας κλάδος δύο άνθρακα στον άνθρακα 2.
2ο μέρος: "-έγκλειστος-" υποδεικνύει την παρουσία πέντε άνθρακα στην κύρια αλυσίδα.
3ο μέρος: "-ένα-" είναι το infix που εφαρμόζεται σε ακόρεστες αλυσίδες (χωρίς διπλούς ή τριπλούς δεσμούς).
4ο μέρος: "-Ο" είναι το χαρακτηριστικό επίθημα των υδρογονανθράκων.
→ Παράδειγμα 4
Για αλυσίδες με περισσότερα από ένα υποκαταστήματα, τοποθετήστε τις ρίζες στην ονοματολογία με αλφαβητική σειρά. Εάν υπάρχουν κλάδοι και ακόρεστοι στο ίδιο μόριο, ο αριθμός των ανθράκων στην κύρια αλυσίδα πρέπει να γίνεται με τέτοιο τρόπο ώστε το άθροισμα των αριθμών θέσης να είναι όσο το δυνατόν μικρότερο.
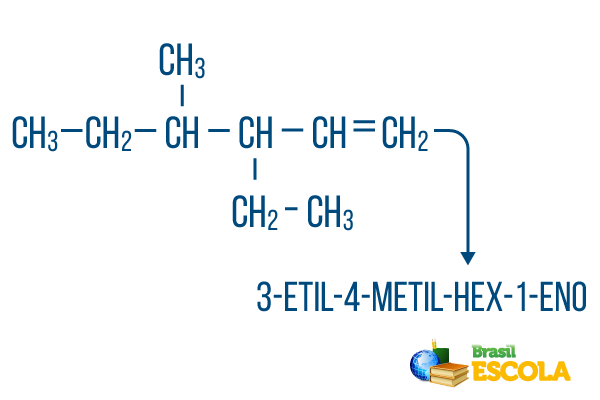
Η μέτρηση του άνθρακα της κύριας αλυσίδας έγινε από αριστερά προς τα δεξιά και το άθροισμα των αριθμών ακορεστότητας και θέσης κλάδου είναι: 1 + 4 + 3 = 8. Εάν ο αριθμός άνθρακα ήταν από δεξιά προς τα αριστερά, η σύνθετη ονοματολογία θα ήταν 4-αιθυλ-3-μεθυλ-5-ένιο, του οποίου το άθροισμα των τοποθεσιών θα είναι: 4 + 3 + 5 = 12, το οποίο είναι μεγαλύτερο από την άλλη υπόθεση, επομένως δεν πρέπει να χρησιμοποιείται.
1ο μέρος: 3-αιθυλ-4-μεθυλ κάνει αναφορά στις ρίζες με αλφαβητική σειρά και τις αντίστοιχες θέσεις τους.
2ο μέρος: μαγεύω- σημαίνει ότι υπάρχουν 6 άνθρακες στην κύρια αλυσίδα.
3ο μέρος: 1-el δείχνει την παρουσία ενός διπλού δεσμού στον άνθρακα 1.
4ο μέρος: "-Ο" είναι το χαρακτηριστικό επίθημα των υδρογονανθράκων.
→ Παράδειγμα 5
Για κλειστές χορδές, οι κανόνες ονομασίας ισχύουν, αλλά η λέξη κύκλος ξεκινά το όνομα της ένωσης, υποδεικνύοντας ότι είναι ένας κλειστός ή κυκλικός υδρογονάνθρακας.
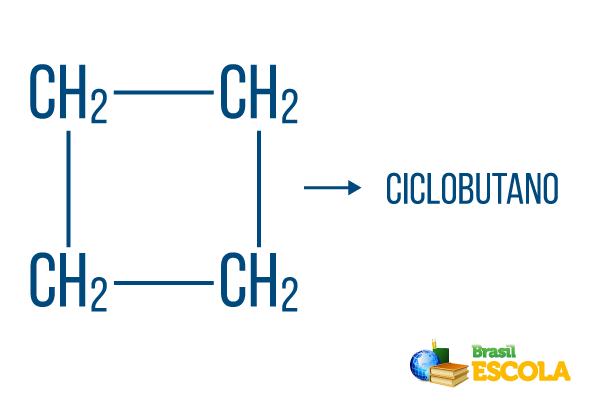
1ο μέρος: κύκλος- δείχνει ότι είναι μια κλειστή συμβολοσειρά.
2ο μέρος: -αλλά- δηλώνει την ύπαρξη 4 άνθρακα στην αλυσίδα
3ο μέρος: -Οείναι το χαρακτηριστικό επίθημα των υδρογονανθράκων.
Διαβάστε επίσης: Ταξινόμηση των αλυσίδων άνθρακα
Τύποι υδρογονανθράκων
Οι υδρογονάνθρακες μπορούν να χωριστούν σε αλκάνια, αλκένια, αλκύνια και αλκαδιένια - τα οποία ταξινομούνται ως σύμφωνα με την καθιέρωση της αλυσίδας (διπλοί ή τριπλοί δεσμοί) - και κυκλάνες, οι οποίες είναι οι αλυσίδες κλειστό.
→ Αλκάνια: είναι υδρογονάνθρακες που δεν έχουν ακόρεστο. Ο γενικός τύπος για τα αλκάνια είναι CόχιΗ2n + 2, και το όχιονοματολογία αποτελείται από πρόθεμα + ένα + Ο.
Εσείς αλκάνια μπορεί να βρεθεί στη φύση, όπως το αέριο μεθάνιο (CH4), το οποίο απελευθερώνεται από ζώα και παράγεται σε διεργασίες αποσύνθεσης, καθώς και σε διυλιστήρια και πετροχημικές βιομηχανίες. Ενώσεις όπως προπάνιο (ΝΤΟ3Η7), βουτάνιο (ΝΤΟ4Η10, το οποίο αποτελεί το αέριο μαγειρικής μας (LPG) και το οκτάνιο (ΝΤΟ8Η18), που υπάρχουν στα καύσιμα αυτοκινήτων, είναι υποπροϊόντα της Πετρέλαιο.

→ αλκένια ή αλκένια: είναι αλυσίδες άνθρακα που έχουν ακόρεστο, διπλό δεσμό. Ο γενικός τύπος του είναι CόχιΗ2ηκαι το δικό σας όχιονοματολογία αποτελείται από Πεπιδιόρθωση + en + ο.

Ο αέριο αιθυλένιο (ΝΤΟ2Η4), που χρησιμοποιείται στη γεωργία για να επιταχύνει την ωρίμανση των φρούτων, ανήκει στη λειτουργία αλκένιο. Η ένωση χρησιμοποιείται επίσης στην παραγωγή πρώτων υλών πολυαιθυλενο, χρησιμοποιείται στην κατασκευή πλαστικών σκευών.
→ Αλκίνες ή ακετυλενικό: υδρογονάνθρακες με τριπλό δεσμό. Ο γενικός τύπος του είναι CόχιΗ2n - 2. Ο ονοματολογία αποτελείται από πρόθεμα + σε + o.

Ο ασετυλίνη ή αιτίνη (C2Η2) είναι ένα αέριο της συνάρτησης αλκυνίου που χρησιμοποιείται στο συγκολλήσεις και μεταλλικά τεμάχια. Αυτή η ένωση μπορεί να φτάσει σε θερμοκρασίες έως 3.000 ° C, γεγονός που επιτρέπει την πραγματοποίηση επισκευών σε βυθισμένα μέρη ενός πλοίου.

→ αλκαδιένια ή διένια: αλυσίδες άνθρακα με δύο ακόρεστους, δηλαδή δύο διπλούς δεσμούς μεταξύ άνθρακα. Ο γενικός τύπος για αυτήν τη συνάρτηση είναι C.όχιΗ2n - 2. Συνειδητοποιήστε ότι είναι ο ίδιος τύπος με τα αλκύνια, που σημαίνει ότι μπορεί να συμβεί ισομερισμός μεταξύ ενώσεων (ίδιος μοριακός τύπος για διαφορετικές ενώσεις).
Η ονοματολογία ενός αλκαδιενίου αποτελείται από Πεπιδιόρθωση + dien + o.
Παράδειγμα:

→ Υδρογονάνθρακες κλειστής αλυσίδας: τα μόρια οργανώνονται με κυκλικό τρόπο, τείνουν να σχηματίζουν ένα πολύγωνο και, όπως σε ανοιχτές αλυσίδες, μπορεί να υπάρχουν εγκαταστάσεις και / ή διακλαδώσεις. Οι κυκλώνες, οι κυκλένες, οι κυκλικές και τα βενζόλια είναι υδρογονάνθρακες κλειστής αλυσίδας.
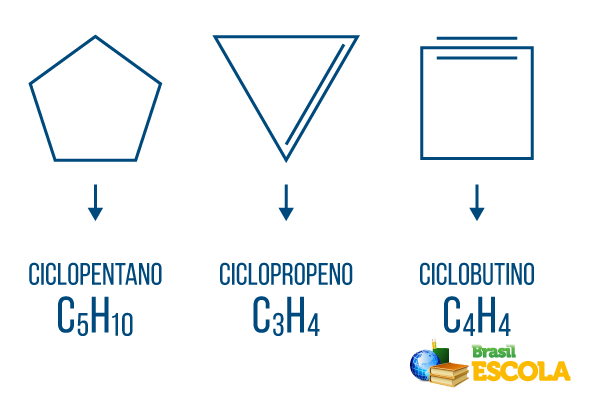
Κυκλώνες ή κυκλοαλκάνια: κυκλικές αλυσίδες που αποτελούνται μόνο από απλούς δεσμούς. Ο γενικός τύπος του είναι CόχιΗ2η. Ονοματολογία: γiclo + πρόθεμα + an + o.
Κύκλοι ή κυκλοαλκένια: κλειστές αλυσίδες υδρογονανθράκων με εγκατάσταση. Ο γενικός τύπος του είναι CόχιΗ2n-2. Ονοματολογία: ντοiclo + πρόθεμα + en + Ο.
-
Κυκλίνες ή κυκλοαλκίνες: υδρογονάνθρακες κλειστής αλυσίδας με την παρουσία δύο διπλών δεσμών. Ο γενικός τύπος του είναι CόχιΗ2n-4. Ονοματολογία: ντοiclo + πρόθεμα + σε + o.
βενζόλια
Βενζόλιο είναι ένας τύπος υδρογονανθράκων κλειστής αλυσίδας με έξι άνθρακες όπου τα ομόλογα ποικίλλουν μεταξύ ενός και διπλού. Αυτές οι ενώσεις είναι τοξικός και πολύ καρκινογόνο, που χρησιμοποιείται ως οργανικός διαλύτης σε χημικές διεργασίες.
Για να θεωρηθεί ο υδρογονάνθρακας αρωματικός, πρέπει να υπάρχει τουλάχιστον ένας δακτύλιο βενζολίου, το οποίο είναι εξαιρετικά αντιδραστικό, επομένως υπόκειται σε δύο ή περισσότερα αντικαταστάσεις, το οποίο θα δούμε εδώ ως επιπτώσεις. Όταν υπάρχουν δύο ρίζες σύνδεσης, θα έχουμε συγκεκριμένα ονόματα για κάθε ζεύγος θέσεων.
Ακτινικά σε 1,2 άνθρακες βενζολίου → Ορθο
Ριζοσπαστικά στους 1,3 άνθρακες βενζολίου → στόχος
Ακτινικά σε άνθρακα 1,4 βενζολίου → Για
Η ονοματολογία μιας αρωματικής ένωσης γίνεται ως εξής:
1ο μέρος: τοποθέτηση των προσδεμάτων (ortho, στόχος ή προς).
2ο μέρος: όνομα της ρίζας ή των ριζών που συνδέονται με το βενζόλιο (μεθύλιο, αιθύλιο, προπύλιο…). Το όνομα που δίνεται στις ρίζες ακολουθεί τον κανόνα άλλων υδρογονανθράκων.
- 3ο μέρος: -σιδηλητήριο, που είναι ο χαρακτηριστικός όρος των αρωματικών υδρογονανθράκων.
Παραδείγματα:
→ Ορθο-διμεθυλο-βενζόλιο

1ο μέρος: Οrto- δείχνει ότι οι ρίζες τοποθετούνται στους άνθρακες 1 και 2.
2ο μέρος: -διμεθυλ- αναφέρεται στις δύο ρίζες, και οι δύο με έναν άνθρακα.
3ο μέρος: -βενζόλιο είναι ο χαρακτηριστικός όρος για τους αρωματικούς υδρογονάνθρακες.
→ Ορθο-αιθυλ-μεθυλ-βενζόλιο
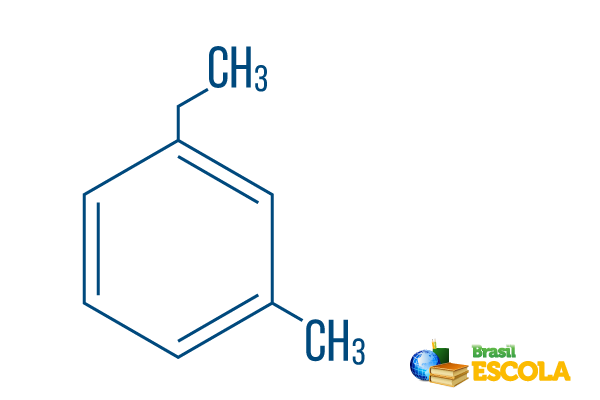
1ο μέρος: Μω- δείχνει ότι οι ρίζες τοποθετούνται στους άνθρακες 1 και 3.
2ο μέρος: αιθυλ-μεθυλ- αναφέρεται στην ποσότητα του άνθρακα σε κάθε ρίζα αιθύλιο ο κλάδος δύο άνθρακα και μεθύλιο διακλάδωση με έναν άνθρακα - τοποθετημένο στην ονοματολογία με αλφαβητική σειρά.
3ο μέρος: -βενζόλιο είναι ο χαρακτηριστικός όρος για τους αρωματικούς υδρογονάνθρακες.
→ παρα-διαιθυλ-βενζόλιο
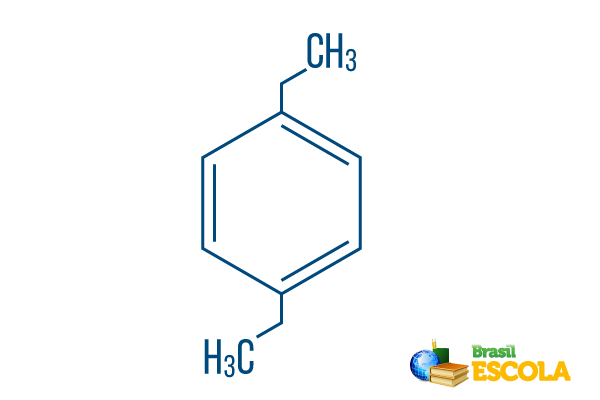
1ο μέρος: Πάροτρο- δείχνει ότι οι ρίζες βρίσκονται στους άνθρακες 1 και 4 του βενζολίου.
2ο μέρος: -διαιθυλ- κάνει αναφορά σε δύο ρίζες του τύπου αιθύλιο, δηλαδή, δύο κλαδιά με δύο άνθρακες το καθένα.
3ο μέρος: -βενζόλιο είναι ο χαρακτηριστικός όρος για τους αρωματικούς υδρογονάνθρακες.
Διαβάστε επίσης:Ανακάλυψη της δομής του βενζολίου
λύσεις ασκήσεις
(Unesp) - Το οκτάνιο είναι ένα από τα κύρια συστατικά της βενζίνης, το οποίο είναι ένα μείγμα υδρογονανθράκων. Ο μοριακός τύπος του οκτανίου είναι:
α) C8H18
β) C8H16
γ) C8H14
δ) C12H24
ε) C18H38
Απάντηση: γράμμα α). Ανάλυση της σύνθετης ονοματολογίας οκτάνιο, είναι ένα αλκάνιο, δηλαδή ένα μόριο που αποτελείται μόνο από απλούς δεσμούς. Εάν ο γενικός τύπος για τα αλκάνια είναι CόχιΗ2n + 2, αντικαθιστώντας το "n" με οκτώ, που είναι η ποσότητα των ανθράκων στην κύρια αλυσίδα - και μοναδική σε αυτήν την περίπτωση -, θα έχουμε ότι ο μοριακός τύπος του οκτανίου είναι C8H18.
(UFSCar-SP) - Εξετάστε τις ακόλουθες δηλώσεις σχετικά με τους υδρογονάνθρακες.
I) Οι υδρογονάνθρακες είναι οργανικές ενώσεις που αποτελούνται μόνο από άνθρακα και υδρογόνο.
II) Μόνο ακόρεστοι υδρογονάνθρακες ευθείας αλυσίδας ονομάζονται αλκένια.
III) Τα κυκλοαλκάνια είναι κορεσμένοι αλειφατικοί υδρογονάνθρακες με τον γενικό τύπο CnH2n.
IV) Είναι αρωματικοί υδρογονάνθρακες: βρωμοβενζόλιο, π-νιτροτολουόλιο και ναφθαλίνιο.
Οι ακόλουθες δηλώσεις είναι σωστές:
α) μόνο I και III.
β) Μόνο I, III και IV.
γ) μόνο II και III.
δ) Μόνο III και IV.
ε) Μόνο I, II και IV.
Απάντηση: Γράμμα α).
II - Τα αλκένια είναι ενώσεις με διπλό δεσμό, δηλαδή, ακόρεστες, αλλά μπορούν να έχουν επιπτώσεις στην αλυσίδα τους, χωρίς να είναι αποκλειστικά γραμμικές.
IV - Οι ενώσεις βρωμεθοβενζολίου και ρ-νιτροτολουολίου ανήκουν σε άλλες οργανικές λειτουργίες.
από τη Laysa Bernardes
Καθηγητής Χημείας