Ισομερισμός Είναι ένα φυσικό φαινόμενο στο οποίο διαφορετικές ουσίες (από άποψη χημικών και φυσικών ιδιοτήτων) έχουν ακριβώς τον ίδιο μοριακό τύπο, όπως στο ακόλουθο παράδειγμα:
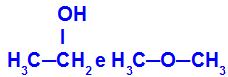
Διαφορετικές ουσίες που έχουν τον ίδιο μοριακό τύπο
Η αιθανόλη (αριστερά) έχει τον μοριακό τύπο C2Η6O, το οποίο εμφανίζεται επίσης με μεθοξυαιθάνιο (δεξιά), έτσι είναι ισομερή.
Τύποι ισομερισμού
→ επίπεδο ισομερές
Είναι ο τύπος του ισομερισμού που μελετά τις δομικές διαφορές μεταξύ των ισομερών.
Ο) Κατοχή
Είναι ο τύπος του επίπεδου ισομερισμού στον οποίο η διαφορά μεταξύ των ουσιών βασίζεται στη διαφορά μεταξύ των οργανικών λειτουργιών στις οποίες ανήκουν. Δείτε μερικά παραδείγματα:
Προπανόνη και προπάνιο:
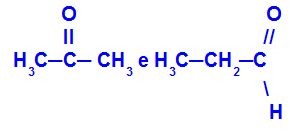
Ισομερή που ανήκουν σε διαφορετικές λειτουργίες
Η προπανόνη (αριστερά) ανήκει στην ομάδα κετόνης και η προπανόλη (δεξιά) ανήκει στην ομάδα αλδεϋδης.
ΣΙ) Φυλακή
Είναι ο τύπος του επίπεδου ισομερισμού στον οποίο η διαφορά μεταξύ ουσιών βασίζεται στη διαφορά μεταξύ των αλυσίδων που παρουσιάζουν. Δείτε ένα παράδειγμα:
2-μεθυλ-προπάνιο και βουτάνιο
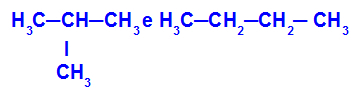
Ισομερή που έχουν αλυσίδες με διαφορετικές ταξινομήσεις
Στο παράδειγμα, μπορούμε να δούμε ότι το 2-μεθυλ-προπάνιο (στα αριστερά) έχει διακλαδισμένη αλυσίδα και το βουτάνιο (στα δεξιά) έχει μια φυσιολογική αλυσίδα.
ντο) Θέση
Είναι ο τύπος του επίπεδου ισομερισμού στον οποίο η διαφορά μεταξύ των ουσιών βασίζεται στη διαφορά της θέσης ενός συστατικού που υπάρχει στις αλυσίδες τους. Δείτε ένα παράδειγμα:
1-χλωρο-προπάνιο και 2-χλωρο-προπάνιο
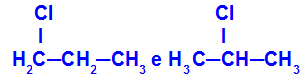
Ισομερή που έχουν εξαρτήματα σε διαφορετικές θέσεις στην αλυσίδα
Στο παράδειγμα, μπορούμε να δούμε ότι το 1-χλωρο-προπάνιο (στα αριστερά) έχει το χλώριο τοποθετημένο στον άνθρακα 1, και το 2-χλωρο-προπάνιο (στα δεξιά) έχει το χλώριο τοποθετημένο στον άνθρακα 2.
ρε) Metameria ή αποζημίωση
ΣΗΜΕΙΩΣΗ: Ο ισομερισμός ισχύει αποκλειστικά για ετερογενείς χορδές.
Είναι ο τύπος του επίπεδου ισομερισμού στον οποίο η διαφορά μεταξύ των ουσιών βασίζεται στη διαφορά της θέσης ενός ετεροάτομου που υπάρχει στις αλυσίδες τους. Δείτε ένα παράδειγμα:
Παράδειγμα: Μεθοξυπροπάνιο και αιθοξυαιθάνιο
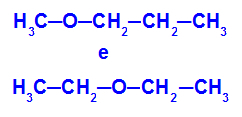
Ισομερή που έχουν ετεροάτομα σε διαφορετικές θέσεις στην αλυσίδα
Στο παράδειγμα, μπορούμε να δούμε ότι, στο μεθοξυπροπάνιο (αριστερά), το οξυγόνο έχει μια ρίζα με έναν άνθρακα στη μία πλευρά και τρεις άνθρακες στην άλλη. Στο αιθοξυαιθάνιο (δεξιά), το οξυγόνο έχει μια ρίζα με δύο άνθρακες στη μία πλευρά και δύο άνθρακες στην άλλη.
και)Ταυτομετρικά
Πρόκειται για μια συγκεκριμένη περίπτωση ισομερισμού της λειτουργίας του επιπέδου και εμφανίζεται σε τρεις μόνο οργανικές λειτουργίες:
Αλδεγύδη
κετόνη
Ενόλ
Αυτός ο τύπος ισομερισμού λειτουργεί στο γεγονός ότι υπάρχει μια χημική ισορροπία μεταξύ μιας ενόλης και μιας αλδεΰδης και μεταξύ μιας ενόλης και μιας κετόνης, δηλαδή, αυτά τα συστατικά μετατρέπονται συνεχώς μεταξύ τους. Δείτε ένα παράδειγμα:
Prop-2-en-1-ol και προπανόνη
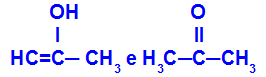
Ισομερή που ανήκουν σε διαφορετικές λειτουργίες
Στο παράδειγμα, μπορούμε να δούμε ότι το Prop-2-en-1-ol (στα αριστερά) ανήκει στην ομάδα των ενόλων και η προπανόνη (στα δεξιά) ανήκει στην ομάδα των κετονών, οπότε είναι ισομερή ταυτομερούς.
→ Διαστημικός ισομερισμός
Είναι ένας τύπος ισομερισμού που ορίζεται από τη χωρική ανάλυση του μορίου.
α) Γεωμετρικά ισομερή
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Είναι ένας τύπος χωρικού ισομερισμού που εμφανίζεται όταν η ουσία έχει μόρια με τα ακόλουθα χαρακτηριστικά:
Κλειστή αλυσίδα που έχει δύο άνθρακες με δύο διαφορετικά προσδέματα, όπως στο παρακάτω παράδειγμα:

Κλειστή δομή με γεωμετρικό ισομερισμό
Ανοικτή αλυσίδα που έχει διπλό δεσμό μεταξύ των ανθράκων και, σε καθέναν από αυτούς τους άνθρακες του διπλού δεσμού, υπάρχουν δύο διαφορετικοί προσδέτες, όπως στο παρακάτω παράδειγμα:
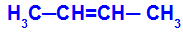
Ανοιχτή δομή με γεωμετρικό ισομερισμό
Ο γεωμετρικός ισομερισμός χωρίζεται σε δύο ομάδες:
1Ο Ομάδα: cis-trans
Εμφανίζεται όταν τα δύο προσδέματα ενός άνθρακα είναι αυστηρά ίσα με τα δύο προσδέματα του άλλου άνθρακα, είτε στην ανοιχτή δομή είτε στην κλειστή δομή.
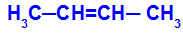
Αλυσίδα μιας ουσίας που έχει ισομερισμό cis-trans
Το ισομερές θα ονομάζεται cis όταν τα ίδια προσδέματα βρίσκονται στο ίδιο επίπεδο.

Παράδειγμα ισομερούς cis
Το ισομερές θα ονομάζεται trans όταν τα διαφορετικά προσδέματα βρίσκονται στο ίδιο επίπεδο.

Παράδειγμα trans ισομερούς
2Ο Ομάδα: Ε-Ζ
Εμφανίζεται όταν τα δύο προσδέματα ενός άνθρακα είναι διαφορετικά σε σχέση με τα δύο προσδέματα του άλλου άνθρακα, είτε στην ανοικτή δομή είτε στην κλειστή δομή.

Αλυσίδα μιας ουσίας που έχει ισομερισμό Ε-Ζ
Το ισομερές θα ονομάζεται Ε όταν τα προσδέματα με τον υψηλότερο ατομικό αριθμό βρίσκονται σε αντίθετα επίπεδα. Στο παρακάτω παράδειγμα, ο άνθρακας στα αριστερά έχει το Br με τον υψηλότερο ατομικό αριθμό (35) και, στο άλλο, υπάρχει οξυγόνο (8).
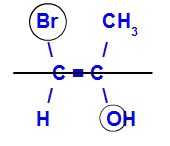
Παράδειγμα Ε-ισομερούς
Το ισομερές θα ονομάζεται Ζ όταν τα προσδέματα με τον υψηλότερο ατομικό αριθμό βρίσκονται στο ίδιο επίπεδο. Στο παρακάτω παράδειγμα, ο άνθρακας στα αριστερά έχει το Br με τον υψηλότερο ατομικό αριθμό (35) και, στο άλλο, υπάρχει οξυγόνο (8).

Παράδειγμα Ζ-ισομερούς
ΣΙ) οπτικό ισομερές
Είναι ένας τύπος χωρικού ισομερισμού που εμφανίζεται μόνο όταν η ουσία έχει μόρια με χειραλικός άνθρακας (αυτό που έχει τέσσερα διαφορετικά προσδέματα) στις δομές τους. Το μόριο με χειρόμορφο άνθρακα έχει την ικανότητα να πόλωσε και να εκτρέψει το φως, ως εξής:
Στα δεξιά (δεξιό ισομερές)
Αριστερά (levorotatory isomer)
Μια ένωση με οπτική δραστηριότητα έχει πάντα ενεργά ισομερή (ονομάζονται οπτικοί αντίποδες) και ανενεργά ισομερή (μείγμα μεταξύ δύο ενεργών ισομερών, ένα μείγμα που ονομάζεται ρακεμικό).
Μπορούμε να χρησιμοποιήσουμε τον ακόλουθο τύπο για να προσδιορίσουμε τον αριθμό των ενεργών (IOA) και ανενεργών (IOI) ισομερών μιας ένωσης που έχει χειρόμορφο άνθρακα:
ΙΟΑ = 2όχι
ΙΟΙ = 2όχι
2
Ακολουθεί ένα παράδειγμα μιας ένωσης που έχει γεωμετρικό ισομερισμό:
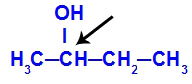
Ο χηλικός άνθρακας εμφανίζεται σε βουταν-2-όλη
Η δομή του βουτανίου-2-ol έχει τα ακόλουθα προσδέματα:
Μεθύλιο (CH3)
Αιθύλιο (CH3-CH2)
Υδρογόνο (Η)
Υδροξυλ (ΟΗ)
Επειδή έχει μόνο έναν χειρικό άνθρακα, επομένως, η βουταν-2-όλη έχει:
Ενεργά ισομερή:
IOA = 21
IOA = 2
Ανενεργά ισομερή:
IOI = 21
2
IOI = 2
2
IOI = 1
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Τι είναι ο ισομερισμός;"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Πρόσβαση στις 27 Ιουνίου 2021.
