Στο αντιδράσεις καύσης είναι παρόντες σε πολλές πτυχές της καθημερινής μας ζωής. Για παράδειγμα, οι κύριες πηγές παραγωγής ενέργειας προκύπτουν από την καύση ή καύση ορισμένων καυσίμων, όπως αιθανόλη, βενζίνη, κάρβουνο, μεταξύ άλλων. Επιπλέον, η ενέργεια που χρειαζόμαστε για να επιβιώσουμε και για να κάνουμε δουλειά είναι το αποτέλεσμα αντιδράσεων καύσης που συμβαίνουν στα κύτταρα μας όταν «καίμε» τα τρόφιμα που τρώμε.
Αλλά τι χρειάζεται για να έχουμε μια αντίδραση καύσης;
Απαιτούνται τρία πράγματα:
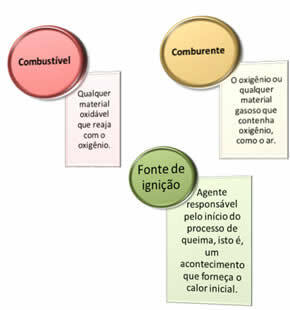
Αυτοί οι τρεις παράγοντες αποτελούν το τρίγωνο φωτιάς, επειδή μόλις ξεκινήσει η αντίδραση καύσης, η ενέργεια που απελευθερώνεται διατηρεί την αντίδραση και της επιτρέπει να συνεχίσει έως ότου εξαφανιστεί το καύσιμο, οξειδωτής ή θερμότητα (απελευθερούμενη ενέργεια). Αυτό σημαίνει ότι θα υπάρχει Αλυσιδωτή αντίδραση.
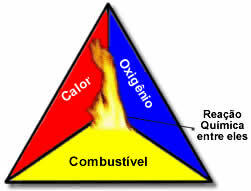
Για παράδειγμα, εάν κάποιος ρίξει ένα αναμμένο τσιγάρο σε ένα δάσος, θα υπάρξει φωτιά (αντίδραση καύσης). Σε αυτήν την περίπτωση, το Θάμνος είναι το καύσιμαΟ οξυγόνο που υπάρχει στον αέρα
η ατμοσφαιρική είναι η οξειδωτής είναι το τσιγάρο άναψε ήταν το πηγή ανάφλεξης. Αυτή η καύση θα συνεχιστεί έως ότου εξαλειφθεί ένας από τους τρεις παράγοντες. Εάν οι πυροσβέστες ρίξουν νερό, η θερμότητα θα εξαλειφθεί. Αλλά ακόμη και αν δεν γίνει τίποτα για να σταματήσει αυτό το κάψιμο, θα τελειώσει κάποια στιγμή, δηλαδή όταν τελειώσει το καύσιμο (ζιζάνιο).Όπως ήδη αναφέρθηκε, σε αυτές τις αντιδράσεις η θερμότητα απελευθερώνεται, επομένως η καύση είναι μια εξώθερμη αντίδραση. Ωστόσο, αυτός ο τύπος αντίδρασης είναι ατελής καύση. Για να καταλάβετε γιατί, δείτε τη διαφορά μεταξύ πλήρους και ατελούς καύσης:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Πλήρης καύση:
Αναλύοντας τις οργανικές ενώσεις ως καύσιμα, πρέπει:
| Ο πλήρης καύση Θα συμβεί όταν η ανθρακική αλυσίδα έχει σπάσει και όλα τα άτομα άνθρακα στην ανθρακική αλυσίδα οξειδώνονται πλήρως. |
| Εσείς διαμορφωμένα προϊόντα από τους υδρογονάνθρακες θα είναι το CO2 (διοξείδιο του άνθρακα) και Η2Ο (Νερό). |
Παρατηρήστε την πλήρη καύση του ισοκτανίου, που είναι ένα από τα συστατικά της βενζίνης.
ΝΤΟ8Η18 (ζ) +25/2 Ο2 (ζ) → 8 CO2 (ζ) + 9 π.μ.2Ο(1)
Ατελής καύση
| Σε αυτήν την περίπτωση, δεν υπάρχει αρκετό οξειδωτικό, δηλαδή αρκετό οξυγόνο για να κάψει όλο το καύσιμο. |
| Έτσι, τα προϊόντα που σχηματίζονται είναι CO (μονοξείδιο του άνθρακα) και Η2Ο. |
Παρατηρήστε την ίδια καύση ισοκτανίου, ωστόσο, τώρα ημιτελής:
ΝΤΟ8Η18 (ζ) + 17/2 Ο2(σολ) → 8 CO (σολ) + 9 π.μ.2Ο(1)
Η καύση των δασών είναι ένα παράδειγμα, καθώς οι προκύπτουσες εκπομπές αποτελούνται από CO και συγκεκριμένη ύλη, όπως αιθάλη (C), καθώς και τέφρα και άλλες απλές και πολύπλοκες οργανικές ενώσεις. Το οξείδιο του αζώτου, το όζον και οι αλδεΰδες μπορούν επίσης να σχηματιστούν ως αποτέλεσμα δευτερογενών αντιδράσεων λόγω της παρουσίας άλλων συστατικών στον αέρα.
ΝΤΟ8Η18 (ζ) + 9/2 Ο2 (ζ) → 8C (σολ) + 9 π.μ.2Ο(1)
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Σχολική ομάδα της Βραζιλίας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Πλήρης και ατελής καύση". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm. Πρόσβαση στις 27 Ιουνίου 2021.