Ο Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) ήταν ένας Ιταλός χημικός που καθιέρωσε για πρώτη φορά την ιδέα ότι το δείγμα ενός στοιχείου, με μάζα σε γραμμάρια αριθμητικά ίση με την ατομική του μάζα, έχει πάντα τον ίδιο αριθμό ατόμων (Ν).
Ο ίδιος ο Avogadro δεν μπόρεσε να προσδιορίσει την τιμή του N. Ωστόσο, κατά τη διάρκεια του εικοστού αιώνα, η πρόοδος της τεχνολογίας και της επιστημονικής γνώσης κατέστησε δυνατή την ανάπτυξη τεχνικών για τον προσδιορισμό άλλων επιστημόνων. Όταν τελικά ανακαλύφθηκε αυτή η τιμή, κλήθηκε Η σταθερά του Avogadro, προς τιμήν αυτού του επιστήμονα, καθώς αυτός ήταν που έθεσε τα θεμέλια για τη δημιουργία του.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
Σε 1 γραμμομόριο οποιασδήποτε οντότητας (άτομα, μόρια, ηλεκτρόνια, τύποι ή ιόντα) περιέχεται ακριβώς η τιμή της σταθεράς του Avogadro.
Ο παρακάτω πίνακας δείχνει μερικές τιμές για τη σταθερά του Avogadro που αποκτήθηκε κατά τη διάρκεια του 20ού αιώνα:
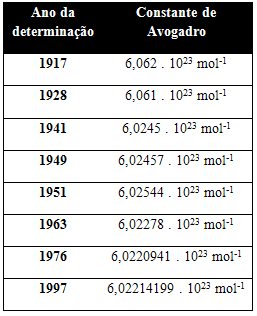
Ακολουθούν μερικές από τις τεχνικές που χρησιμοποιούνται για να προσπαθήσετε να προσδιορίσετε την τιμή της σταθεράς του Avogadro:
Ο πρώτος επιστήμονας που έκανε έναν κατά προσέγγιση υπολογισμό για τη σταθερά του Avogadro ήταν ο Johann Joseph Loschmidt. Το έτος 1867, βασίστηκε στην κινητική θεωρία των αερίων και καθόρισε πόσα μόρια υπήρχαν σε 1 cm3 ενός αερίου.
Ένας άλλος από αυτούς τους επιστήμονες ήταν ο Γάλλος Jean Baptiste Perrin (1870-1942) που μετρούσε τον αριθμό των κολλοειδών σωματιδίων ανά μονάδα όγκου σε ένα εναιώρημα και μέτρησε τις μάζες τους. Η τιμή που βρήκε ήταν μεταξύ 6,5 και 7,2. 1023 οντότητες ανά mol. Αυτός ο επιστήμονας δημοσίευσε, το 1913, το βιβλίο Les Atomes (1η έκδοση Παρίσι: Alcan) και η 9η έκδοσή του, που δημοσιεύθηκε το 1924, περιείχαν 16 τρόπους για να αποκτήσουν πειραματικά τη σταθερά του Avogadro.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)

Jean Baptiste Perrin (1870-1942)
Χρόνια αργότερα, ο επιστήμονας James Dewar (1842-1923) χρησιμοποίησε μια μέθοδο που αναπτύχθηκε χρόνια νωρίτερα από τον ραδιοχημικό Bertram Boltwood (1870-1927) και τον φυσικό Ernest Rutherford (1871-1937), που βασικά συνίστατο στην καταμέτρηση των σωματιδίων άλφα που εκπέμπονται από μια ραδιενεργή πηγή και τον προσδιορισμό του όγκου του ληφθέντος αερίου ηλίου. Η τιμή που βρέθηκε από τον Dewar ήταν 6.04. 1023 mol-1.
Τον 20ο αιώνα, ο Robert Millikan (1868-1953) πραγματοποίησε ένα πείραμα για τον προσδιορισμό της φόρτισης του ηλεκτρονίου (1.6. 10-19 ΝΤΟ). Καθώς το φορτίο 1 mol ηλεκτρονίων ήταν ήδη γνωστό (96500 C), ήταν δυνατόν να συσχετιστούν αυτές οι δύο τιμές και να βρεθεί η ακόλουθη τιμή για τη σταθερά του Avogadro: 6.03. 1023 mol-1.
Επί του παρόντος, η προτεινόμενη τιμή για τη σταθερά του Avogadro είναι 6.02214 x 1023 mol-1 και προσδιορίζεται μέσω διάθλασης ακτίνων Χ, στην οποία λαμβάνεται ο όγκος μερικών ατόμων ενός κρυσταλλικού πλέγματος, αρκεί να είναι γνωστή η πυκνότητα και η μάζα 1 mole ατόμων στο δείγμα.
Για διδακτικούς σκοπούς, στο Γυμνάσιο, όπου οι υπολογισμοί δεν χρειάζεται να είναι τόσο ακριβείς όσο αυτοί που εκτελούνται σε χημικά εργαστήρια, η σταθερά του Avogadro θεωρείται ως 6,02. 1023 mol-1.
Υπάρχουν επίσης απλούστερες μέθοδοι που μπορούν να χρησιμοποιηθούν για να βοηθήσουν τους μαθητές να προσδιορίσουν τη σταθερά του Avogadro στην πράξη. Ένα από αυτά είναι μέσω ηλεκτρόλυσης σε υδατικό μέσο.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Προσδιορισμός της σταθεράς του Avogadro". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Πρόσβαση στις 28 Ιουνίου 2021.


