Σε αυτό το υλικό, θα ακολουθήσετε αναλύσεις βήμα προς βήμα και αιτιολογήσεις για τις απαντήσεις διαφόρων ασκήσεις χημικής ισορροπίας, που καλύπτουν πολλά θέματα σε αυτόν τον σημαντικό κλάδο της Φυσικής Χημείας.
1- Σταθερά ισορροπίας όσον αφορά τη συγκέντρωση σε mol / L
Παράδειγμα: (PUC-RS) Μια ισορροπία που εμπλέκεται στο σχηματισμό όξινης βροχής αντιπροσωπεύεται από την εξίσωση:
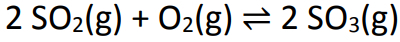
Σε ένα δοχείο ενός λίτρου, αναμίχθηκαν 6 mol διοξειδίου του θείου και 5 moles οξυγόνου. Μετά από κάποιο χρονικό διάστημα, το σύστημα έφτασε σε ισορροπία και ο αριθμός των γραμμομορίων τριοξειδίου του θείου που μετρήθηκε ήταν 4. Η κατά προσέγγιση τιμή της σταθεράς ισορροπίας είναι:
α) 0,53
β) 0,66
γ) 0,75
δ) 1.33
ε) 2.33
Σωστή απάντηση: Γράμμα Δ
Η άσκηση ζητά να υπολογίσει τη σταθερά ισορροπίας σε όρους συγκέντρωσης mol / L. Για να γίνει αυτός ο υπολογισμός, πρέπει να χρησιμοποιήσουμε τιμές ισορροπίας για κάθε συμμετέχοντα στην αντίδραση. Η έκφραση του Kc παρουσιάζει το αποτέλεσμα πολλαπλασιασμού των συγκεντρώσεων των προϊόντων διαιρεμένων με το προϊόν των συγκεντρώσεων των αντιδραστηρίων:
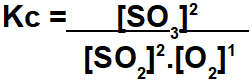
Πρέπει να είμαστε πολύ προσεκτικοί για να προσδιορίσουμε τις τιμές κάθε συμμετέχοντος στο υπόλοιπο, καθώς η άσκηση δεν θα παρέχει πάντα αυτά τα δεδομένα, όπως συμβαίνει σε αυτό το παράδειγμα. Επομένως, πρέπει να ακολουθήσουμε τα παρακάτω βήματα:
Βήμα 1: Συναρμολογήστε έναν πίνακα με γνωστές τιμές.
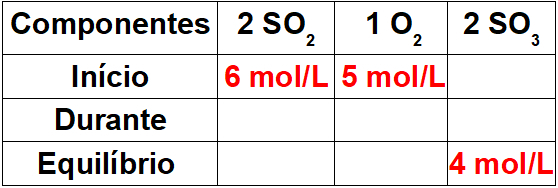
Καθώς αυτή είναι η αρχή της αντίδρασης, το προϊόν θα έχει συγκέντρωση ίση με το μηδέν. Καθώς η τιμή ισορροπίας στο προϊόν είναι πάντα ίση με το άθροισμα της έναρξης και κατά τη διάρκεια, η τιμή κατά τη διάρκεια της αντίδρασης θα είναι 4 mol / L.

Βήμα 2: Προσδιορίστε τις τιμές κατά τη διάρκεια της αντίδρασης.
Για τον προσδιορισμό των τιμών των αντιδραστηρίων κατά τη διάρκεια της αντίδρασης, αρκεί να συσχετιστεί η γνωστή τιμή για το προϊόν με τις τιμές των αντιδραστηρίων χρησιμοποιώντας τη στοιχειομετρική αναλογία. Έχουμε 4 mol / L SO3 κατά τη διάρκεια της αντίδρασης για την αναλογία 2 στο υπόλοιπο. Ως το ποσοστό του λειτουργικού συστήματος2 είναι επίσης 2, θα έχουμε 4 mol / L κατά τη διάρκεια της διαδικασίας. στο O2, θα έχουμε μόνο 2 mol / L, επειδή ο στοιχειομετρικός συντελεστής του είναι 1.

Για να ολοκληρώσετε τον πίνακα, αρκεί να αφαιρέσετε την αρχική τιμή με την τιμή κατά τη διάρκεια, έτσι ώστε να προσδιορίσουμε τις τιμές ισορροπίας για τα αντιδραστήρια.

Βήμα 3: Προσδιορίστε την τιμή του Kc.
Για να προσδιορίσετε την τιμή του Kc, απλώς χρησιμοποιήστε τις τιμές που βρίσκονται στην ισορροπία στην παρακάτω παράσταση:

2- Σταθερά ισορροπίας ως προς τη μερική πίεση
Παράδειγμα: (SANTOS-SP) Παρατηρήστε την εξίσωση ισορροπίας παρακάτω:
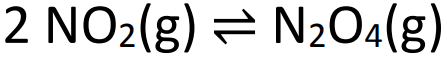
Όταν επιτευχθεί η παραπάνω ισορροπία, η πίεση είναι 2 atm και υπάρχει 50% ΟΧΙ2 σε όγκο. Η τιμή της σταθεράς ισορροπίας σε μερικές πιέσεις (Kp) πρέπει να είναι:
α) 0,2
β) 0,25
γ) 1
δ) 0,5
ε) 0,75
Σωστή απάντηση: Γράμμα Γ
Η άσκηση δείχνει ότι η συνολική πίεση του συστήματος σε ισορροπία είναι 2 atm και ότι υπάρχει 50% (κλάσμα mole) του NO2. Έτσι, αρχικά, πρέπει να προσδιορίσουμε τη μερική πίεση για κάθε αέριο σε ισορροπία πολλαπλασιάζοντας τη συνολική πίεση με το μοριακό κλάσμα:
στο ΟΧΙ2:
pNO2 = 0,5. 2
pNO2 = 1 atm
Στο Ν2Ο4: καθώς υπάρχουν μόνο δύο αέρια στο σύστημα, το ποσοστό Ν2Ο4 θα είναι επίσης 50% να οδηγήσει σε συνολικό 100%.
ρΝ2Ο4 = 0,5. 2
ρΝ2Ο4 = 1 atm
Η σταθερά ισορροπίας, σε όρους μερικών πιέσεων, υπολογίζεται διαιρώντας το αποτέλεσμα του πολλαπλασιασμός μερικών πιέσεων αερίων προϊόντων από το προϊόν πιέσεων αντιδραστηρίων αεριώδης. Σε αυτήν την περίπτωση, η έκφραση του Kp θα είναι:

3- Μετατόπιση ισορροπίας
Παράδειγμα: (PUCCAMP) Ο σχηματισμός σταλακτιτών, εναποθέσεων ανθρακικού ασβεστίου που υπάρχουν σε σπηλιές κοντά σε περιοχές πλούσιες σε ασβεστόλιθο, μπορεί να αναπαρασταθεί με την ακόλουθη αναστρέψιμη αντίδραση:

Λάβετε υπόψη τις ακόλουθες προϋποθέσεις:
ΕΓΩ. Σταθερή εξάτμιση νερού
ΙΙ. Ρεύμα κρύου και υγρού αέρα
III. Αύξηση της θερμοκρασίας μέσα στο σπήλαιο
IV. Μείωση της θερμοκρασίας μέσα στο σπήλαιο
Ποιες από αυτές τις συνθήκες ευνοούν το σχηματισμό σταλακτιτών;
α) I και II
β) I και III
γ) II και III
δ) II και IV
ε) III και IV
Σωστή απάντηση: Γράμμα Β
Οι σταλακτίτες είναι δομές που σχηματίζονται από ανθρακικό ασβέστιο (CaCO3). Η δήλωση αμφισβητεί ποιες από τις αναφερόμενες συνθήκες ευνοούν το σχηματισμό σταλακτιτών. Είναι, συνεπώς, μια άσκηση για μετατόπιση ισορροπίας, επειδή ο σχηματισμός του CaCO3 συμβαίνει όταν η ισορροπία μετατοπίζεται προς την κατεύθυνση σας (προς τα αριστερά).
Αληθινά, επειδή όταν εξατμίζεται, η ποσότητα νερού (που υπάρχει στα αριστερά της ισορροπίας) μειώνεται. Σύμφωνα με αρχή του Le Chatelier, όταν η συγκέντρωση ενός συμμετέχοντα μειώνεται, η ισορροπία μετατοπίζεται πάντα στο πλάι του.
II- Λάθος, καθώς τα σπήλαια είναι κρύα και υγρά μέρη, έτσι η άμεση αντίδραση του σχηματισμού σταλακτιτών είναι εξώθερμη. Εάν ένα ρεύμα κρύου, υγρού αέρα, που ευνοεί την εξώθερμη διαδικασία και αυξάνει την ποσότητα νερού, μπείτε στο σπήλαιο, η αντίδραση θα μετατοπιστεί προς την άμεση κατεύθυνση, δεν ευνοεί τον σχηματισμό σταλακτίτες.
III- Αληθινό, καθώς οι σπηλιές είναι κρύες και υγρές περιοχές και η άμεση αντίδραση είναι εξώθερμη, εάν η θερμοκρασία στο αύξηση σπηλαίου, η αντίδραση θα μετατοπιστεί στην έμμεση κατεύθυνση (ενδοθερμική), η οποία θα ευνοήσει το σχηματισμό του σταλακτίτες.
IV- Λάθος, καθώς οι σπηλιές είναι κρύες και υγρές περιοχές και η άμεση αντίδραση είναι εξώθερμη, εάν η θερμοκρασία μείωση της σπηλιάς, η αντίδραση θα μετατοπιστεί στην άμεση κατεύθυνση (εξώθερμη), η οποία δεν θα ευνοήσει το σχηματισμό σταλακτίτες.
Δείτε επίσης:Χημική ισορροπία σε σπηλιές
4- Σταθερή ιονισμού
Παράδειγμα: (UECE) Η συγκέντρωση [H+] μιας λύσης 6 × 10-7 mol / λίτρο οξέος Η2S, με σταθερά ιονισμού Ki 10-7, είναι το ίδιο με:
α) 5 × 10-7 mol / λίτρο
β) 6 × 10-7 mol / λίτρο
γ) 3 × 10-6 mol / λίτρο
δ) 2 × 10-7 mol / λίτρο
Σωστή απάντηση: Γράμμα Δ
Δεδομένου ότι έχουμε μόνο ένα οξύ ή μία βάση, αυτό είναι μια άσκηση σταθερά ιονισμού (Κι). Έτσι, για να λύσουμε αυτό το είδος ερώτησης, πρέπει να γνωρίζουμε τις συγκεντρώσεις των ιόντων και του ηλεκτρολύτη (οξύ ή βάση).
Για να ξεκινήσουμε την επίλυση μιας άσκησης στη σταθερά ιονισμού, πρέπει να χρησιμοποιήσουμε την εξίσωση ιονισμού οξέος (στην περίπτωση της άσκησης, H2S) ή τη βάση.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)

Σύμφωνα με τη συναρμολογημένη εξίσωση, η συγκέντρωση του Η+ είναι το ίδιο με το HS- σε ισορροπία λόγω της στοιχειομετρικής αναλογίας. Καθώς δεν γνωρίζουμε αυτές τις τιμές, θα χρησιμοποιήσουμε το x και για τις δύο συγκεντρώσεις.
Σημείωση: μπορούμε να χρησιμοποιήσουμε το x και για τις δύο συγκεντρώσεις επειδή ασχολούμαστε με το προϊόν.
Βήμα 1: Συγκέντρωση της έκφρασης Ki.
Το συγκρότημα της έκφρασης της σταθεράς ιονισμού ισορροπίας ακολουθεί την ίδια αρχή της σταθεράς σε όρους συγκέντρωσης σε mol / L.
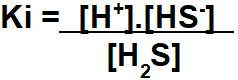
Βήμα 2: Χρησιμοποιήστε τις τιμές που παρέχονται από την άσκηση στη συναρμολογημένη έκφραση Ki.

Βήμα 3: Υπολογίστε την τιμή δέλτα.

Βήμα 4: Υπολογίστε την πιθανή τιμή x για το δέλτα που βρέθηκε.

Για x1
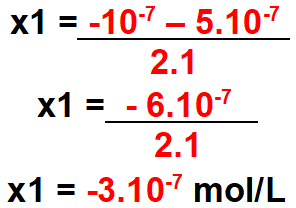
Σημείωση: η συγκέντρωση δεν μπορεί να είναι αρνητική. Επομένως, αυτή η τιμή δεν είναι έγκυρη.
Για x2

5- Ο νόμος της αραίωσης του Ostwald
Παράδειγμα: (ITA) Σε υδατικό διάλυμα 0,100 mol / L ενός μονοκαρβοξυλικού οξέος στους 25 ° C, το οξύ διαχωρίζεται 3,7% μετά την επίτευξη ισορροπίας. Ελέγξτε την επιλογή που περιέχει τη σωστή τιμή για τη σταθερά διαχωρισμού αυτού του οξέος σε αυτήν τη θερμοκρασία.
α) 1.4
β) 1,4 × 10-3
γ) 1,4 × 10-4
δ) 3,7 × 10-2
ε) 3,7 × 10-4
Σωστή απάντηση: Γράμμα Γ
Διά μέσου Ο νόμος της αραίωσης του Ostwald, υπολογίζουμε τη σταθερά ιονισμού (Ki) ενός ισχυρού ηλεκτρολύτη (το α είναι μεγαλύτερο από 5%) χρησιμοποιώντας τον τύπο:

Για τον υπολογισμό της σταθεράς ιονισμού ενός αδύναμου ηλεκτρολύτη (το α είναι μικρότερο από 5%), χρησιμοποιούμε τον ακόλουθο τύπο:
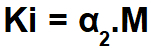
Μια άσκηση σχετικά με τον νόμο της αραίωσης του Ostwald αναγνωρίζεται εύκολα καθώς παρουσιάζει συγκέντρωση σε mol / L (στην περίπτωση αυτή 0,100 mol / L) ενός απλού ηλεκτρολύτη (μονοκαρβοξυλικό οξύ), ποσοστό διαχωρισμού (α = 3,7%) ή σταθερά διαχωρισμού ή ιονισμού (Κι).
Καθώς το οξύ είναι ασθενές, έτσι:

6- Χημική ισορροπία που περιλαμβάνει pH και pOH
Παράδειγμα: (PUC-MG) Σε τρία δοχεία, τα Χ, Υ και Ζ περιέχονται άγνωστα βασικά διαλύματα με συγκέντρωση 0,1 mol / L. Με μέτρηση του pH των τριών διαλυμάτων με γενικό χαρτί δείκτη, ελήφθησαν οι ακόλουθες τιμές, αντίστοιχα: pH = 8, pH = 10 και pH = 13. Επιλέξτε τη σωστή δήλωση:
α) Η συγκέντρωση του ΟΗ- της βάσης Z είναι ίσο με 10-13 φίλη αλήτη.
b) Το Kb από τη βάση X είναι μεγαλύτερο από το Kb από τη βάση Υ.
γ) Η βάση Υ μεταφέρει ηλεκτρικό ρεύμα καλύτερα από τη βάση Ζ.
δ) Η βάση Χ είναι πλήρως ιονισμένη.
ε) Στη φιάλη Z, περιέχεται μια ισχυρή βάση.
Σωστή απάντηση: Γράμμα e
Για να ξεκινήσετε την επίλυση αυτής της άσκησης, είναι απαραίτητο να θυμάστε ορισμένα σημαντικά σημεία:
Πρώτα: pH + pOH = 14
Δεύτερος: όσο υψηλότερο είναι το pH, σε σχέση με την τιμή 7, τόσο πιο βασική θα είναι η λύση. Όσο πιο βασική είναι η λύση, τόσο μεγαλύτερη είναι η συγκέντρωση ανιόντων υδροξειδίου [OH-].
Τρίτος: [ΟΗ-] = 10-POH
Δωμάτιο: όσο μικρότερο είναι το pOH, τόσο μεγαλύτερο είναι το Kb, τόσο πιο ιονισμένη ή αποσυνδεδεμένη θα είναι η βάση.
Έτσι, βάσει αυτής της γνώσης, απλώς ακολουθήστε το βήμα προς βήμα παρακάτω για να επιλύσετε το πρόβλημα:
Βήμα 1: Προσδιορίστε το pOH κάθε διαλύματος.
Για τη λύση X:
pH + pOH = 14
8 + pOH = 14
pOH = 14 - 8
pOH = 6
Για τη λύση Υ:
pH + pOH = 14
10+ pOH = 14
pOH = 14 - 10
pOH = 4
Για τη λύση Z:
pH + pOH = 14
13 + pOH = 14
pOH = 14 - 13
pOH = 1
Βήμα 2: Για να κρίνουμε την εναλλακτική Α, πρέπει να προσδιορίσουμε τη συγκέντρωση υδροξειδίου για το διάλυμα Z.
[ω-] = 10-POH
[ω-] = 10-1 φίλη αλήτη,
Σύντομα, το Η εναλλακτική Α είναι ψευδής.
Βήμα 3: Συγκρίνετε τη βάση X Kb με τη βάση Y.
Η βάση X Kb είναι μικρότερη από τη βάση Y Kb επειδή το pOH του είναι μεγαλύτερο. Σύντομα, το η εναλλακτική Β είναι λανθασμένη.
Βήμα 4: Συσχετίστε το pOH με δύναμη και διαχωρισμό.
Η αγωγή του ηλεκτρικού ρεύματος συμβαίνει καλύτερα σε λύσεις που έχουν ισχυρό ηλεκτρολύτη με υψηλότερο pOH. Η βάση Y δεν μεταδίδει ηλεκτρικό ρεύμα καλύτερα από τη βάση Z επειδή το pOH είναι χαμηλότερο, επομένως λιγότερα ιόντα απελευθερώνονται. Ετσι το η εναλλακτική Γ είναι λανθασμένη.
Βήμα 5: Συσχετίστε το pOH με το διαχωρισμό.
Όσο μικρότερο είναι το pOH, τόσο πιο διαχωρισμένη είναι η βάση. Καθώς το διάλυμα με το υψηλότερο pOH βρίσκεται στο δοχείο X, περιέχει το λιγότερο διαχωρισμένο διάλυμα. Επομένως, ο η εναλλακτική D είναι ψευδής.
Δείτε επίσης: Το pH του στόματος και της φθοράς των δοντιών
7- Ρυθμιστικό διάλυμα
Παράδειγμα: (UFES) Το pH του ανθρώπινου αίματος διατηρείται σε στενό εύρος (7,35 - 7,45) από διαφορετικά ρυθμιστικά συστήματα. Επισημάνετε τη μόνη εναλλακτική λύση που μπορεί να αντιπροσωπεύει ένα από αυτά τα ρυθμιστικά συστήματα:
α) CH3COOH / NaCl
β) HCl / NaCl
γ) Η3ΣΚΟΝΗ4 / ΝΑΝ3
δ) KOH / KCl
ε) Η2CO3 / NaHCO3
Η απάντηση σε αυτήν την ερώτηση είναι η εναλλακτική Ε, επειδή αυτή είναι μια άσκηση στο ρυθμιστικό διάλυμα ή ρυθμιστικό σύστημα. Αυτή η λύση αναφέρεται σε μια χημική ισορροπία που σχηματίζεται από ένα μείγμα δύο διαλυμάτων: ένα οξύ (κατά την άσκηση, το Η2CO3) ή αδύναμη βάση και ένα αλάτι που έχει το ίδιο συστατικό οξέος (κατά την άσκηση, NaHCO3ή τη βάση.
a- Ψευδές, επειδή είναι ένα μείγμα που σχηματίζεται από ένα ασθενές οξύ και ένα άλας που δεν έχει συστατικό οξέος.
b- Λάθος, επειδή είναι ένα μείγμα που σχηματίζεται από ένα ισχυρό οξύ, αφού το HCl είναι ένα από τα τρία ισχυρά υγρά (τα άλλα είναι HBr και HI).
c- Λάθος, επειδή είναι ένα μείγμα που σχηματίζεται από ένα μέτριο οξύ και ένα άλας που δεν έχει όξινο συστατικό.
d- Λάθος, επειδή είναι ένα μείγμα που σχηματίζεται από μια ισχυρή βάση (έχει ένα στοιχείο της οικογένειας αλκαλικών μετάλλων).
Δείτε επίσης: Ρυθμιστικό διάλυμα στο ανθρώπινο αίμα
Από μένα. Diogo Lopes Dias



