Η πολικότητα ενός δεσμού και ενός μορίου σχετίζεται με την κατανομή των ηλεκτρονίων γύρω από τα άτομα.Εάν αυτή η κατανομή είναι συμμετρική, το μόριο θα είναι μη πολικό, αλλά εάν είναι ασύμμετρο, και ένα από τα μέρη του μορίου έχει μεγαλύτερη πυκνότητα ηλεκτρονίων, έτσι είναι ένα πολικό μόριο.
Η πολικότητα των μορίων μπορεί να απεικονιστεί όταν η συστατική τους ουσία υποβάλλεται σε εξωτερικό ηλεκτρικό πεδίο. Εάν τα μόρια προσανατολίζονται στην παρουσία αυτού του πεδίου, δηλαδή, εάν ένα μέρος προσελκύεται στον θετικό πόλο και το άλλο μέρος του μορίου έλκεται στον αρνητικό πόλο, τότε, είναι πολικοί. Σε διαφορετική περίπτωση, αν δεν προσανατολιστούν, είναι μη πολικοί.
Για παράδειγμα, όταν τρίβετε ένα γυάλινο ραβδί με μια φλάντζα, φορτίζεται θετικά. Εάν το προσεγγίσουμε σε ένα ρεύμα νερού που πέφτει από μια βρύση, θα δούμε ότι το νερό δεν θα συνεχίσει να πέφτει σε μια ευθεία κάθετη τροχιά, αλλά θα προσελκύεται από το ραβδί, υποφέροντας απόκλιση. Αυτό δείχνει ότι το νερό είναι πολικό. Αλλά αν κάνουμε αυτό το ίδιο πείραμα με ένα φιλέτο λαδιού, δεν θα παρεκκλίνει στην τροχιά του, δείχνοντας ότι τα μόρια του είναι μη πολικά.
Αναλύοντας τις δομές των μορίων, μπορούμε να προσδιορίσουμε εάν είναι πολικά ή όχι, λαμβάνοντας υπόψη δύο σημαντικούς παράγοντες: η διαφορά στην ηλεκτροπαραγωγικότητα μεταξύ ατόμων και της γεωμετρίας του μορίου.
1η) Ηλεκτροπαραγωγικότητα μεταξύ ατόμων:
Εάν το μόριο σχηματίζεται από δεσμούς μεταξύ ατόμων των ίδιων χημικών στοιχείων, δηλαδή εάν είναι απλές ουσίες όπως το Ο2Χ2, όχι2, Cℓ2, Π4, S8, κ.λπ., θα είναι μη πολικές, επειδή δεν υπάρχει διαφορά στην ηλεκτροαραγωγικότητα μεταξύ των ατόμων τους.
Η μόνη εξαίρεση είναι το μόριο του όζοντος (O3), το οποίο θα το δούμε αργότερα.
Εάν το μόριο είναι διατομικό και σχηματίζεται από στοιχεία διαφορετικών ηλεκτρονανητηρίων, τότε το μόριο θα είναι πολικό. Παραδείγματα: HCℓ, HF, HBr και HI.
2η) Γεωμετρία μορίων:
Η γεωμετρία του μορίου επηρεάζει τον τρόπο κατανομής των ηλεκτρονίων σε αυτό και, κατά συνέπεια, την πολικότητά του. Εάν το μόριο αποτελείται από τρία άτομα ή περισσότερα, θα πρέπει να αναλύσουμε κάθε δεσμό που έχει δημιουργηθεί και τη γεωμετρία του μορίου. Δείτε ένα παράδειγμα: CO2 - γραμμικό μόριο:
δ- δ+ δ-
O = C = Ο
Σημειώστε ότι το οξυγόνο είναι περισσότερο ηλεκτροαρνητικό από τον άνθρακα, έτσι τα ηλεκτρόνια δεσμού προσελκύονται περισσότερο στο οξυγόνο. Σχηματίζεται ένα μερικό αρνητικό φορτίο (δ-, ενώ σε άνθρακα σχηματίζεται ένα μερικό θετικό φορτίο (δ+). Ο πολλαπλασιασμός της απόστασης μεταξύ των πυρήνων των ατόμων που συνδέονται με αυτά τα φορτία στο συντελεστή (δηλαδή, μόνο ο αριθμός χωρίς σύμβολο συν ή πλην) διπολη ΣΤΙΓΜΗ και αντιπροσωπεύεται από μ.
μ = d. |δ|
Αυτή η διπολική ροπή υποδεικνύεται από βέλη που δείχνουν προς την κατεύθυνση του πιο ηλεκτροαρνητικού στοιχείου, το οποίο προσελκύει ηλεκτρόνια: O ← C → O. Αυτό δείχνει ότι αυτή η ποσότητα είναι ένας φορέας (μια ποσότητα που έχει μέγεθος ή ένταση, κατεύθυνση και κατεύθυνση). Επομένως, αντιπροσωπεύεται καλύτερα από:  .
.

Προσθέτοντας όλα τα διανύσματα μαζί, βρίσκουμε την προκύπτουσα διπολική ροπή, 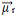 , το οποίο σε αυτήν την περίπτωση ήταν ίσο με το μηδέν, επειδή οι δύο διπολικές ροπές έχουν ίσες τιμές, αλλά πηγαίνουν σε αντίθετες κατευθύνσεις, ακυρώνοντας η μία την άλλη.
, το οποίο σε αυτήν την περίπτωση ήταν ίσο με το μηδέν, επειδή οι δύο διπολικές ροπές έχουν ίσες τιμές, αλλά πηγαίνουν σε αντίθετες κατευθύνσεις, ακυρώνοντας η μία την άλλη.
Όταν το προκύπτον διάνυσμα διπολικής ροπής είναι μηδέν, το μόριο είναι μη πολικό, αλλά αν είναι μη μηδενικό, θα είναι πολικό.
Επομένως, στην περίπτωση του μορίου CO2, είναι απολογημένη.
Τώρα κοιτάξτε ένα άλλο παράδειγμα: H2Ο - γωνιακή γεωμετρία (επειδή το οξυγόνο έχει δύο ζεύγη ηλεκτρονίων διαθέσιμα στο εξώτατο επίπεδο, τα οποία απωθούν τα ηλεκτρόνια από δεσμούς με υδρογόνα):
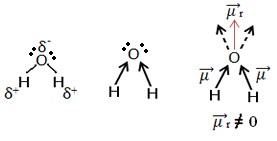
Τα ηλεκτρόνια έλκονται από το οξυγόνο. Όμως, σε αυτήν την περίπτωση, τα διανύσματα δεν ακυρώνουν ο ένας τον άλλον, επειδή η μοριακή γεωμετρία του νερού είναι γωνιακή, από τις κατευθύνσεις της δεν είναι αντίθετα, δίνοντας έναν μηδενικό προκύπτοντα διπολικό ροπή φορέα, και επομένως το μόριο νερού είναι πολικός.
Δείτε περισσότερα παραδείγματα στον παρακάτω πίνακα:
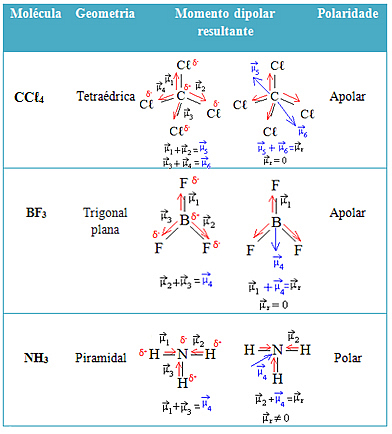
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/polaridade-das-moleculas.htm

