Όταν ακούμε τη λέξη «σιλικόνη» σκεφτόμαστε αμέσως τα εμφυτεύματα στήθους που τοποθετούνται μέσω πλαστικής χειρουργικής. Ωστόσο, η σιλικόνη είναι ένα υλικό που έχει διάφορους σκοπούς, συμπεριλαμβανομένης της χρήσης του σε προϊόντα που καταναλώνουμε συνήθως στην καθημερινή μας ζωή.
Αλλά πριν εξετάσετε αυτές τις εφαρμογές, δείτε τι είναι η χημική σύνθεση της σιλικόνης και πώς παράγεται.
Ο σιλικόνη είναι ένα πολυμερές συμπύκνωσης, δηλαδή, οι μακρές μοριακές τους αλυσίδες σχηματίζονται μέσω αντιδράσεων πολυμερισμού συμπύκνωσης, στις οποίες τα μονομερή, όταν ενώνονται, απελευθερώνουν νερό ή άλλη απλή ουσία.
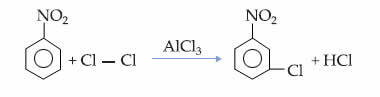
Ο δομή Η βάση σιλικόνης φαίνεται παρακάτω. Σημειώστε ότι αντί του άνθρακα (C) έχουμε το πυρίτιο (Si) ως το κεντρικό στοιχείο, καθώς η κύρια αλυσίδα του πυριτίου αποτελείται από άτομα πυριτίου που εναλλάσσονται με το άτομο οξυγόνου. Αυτό είναι δυνατό επειδή το πυρίτιο ανήκει στην ίδια οικογένεια, στον Περιοδικό Πίνακα, με τον άνθρακα, που έρχεται την περίοδο αμέσως μετά τον άνθρακα. Επομένως, το πυρίτιο έχει ιδιότητες παρόμοιες με αυτές του άνθρακα και, ως εκ τούτου, μπορεί να συνδεθεί με οργανικές ομάδες (R).
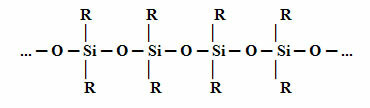
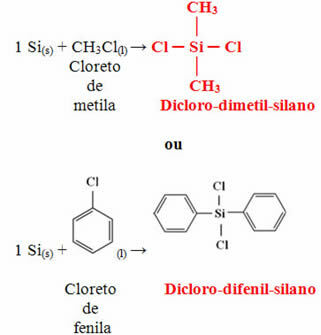
Στην περίπτωση της σιλικόνης, τα πιο συχνά χρησιμοποιούμενα μονομερή στην παραγωγή της είναι το διχλο-διμεθυλ-σιλάνιο ή το διχλωρο-διφαινυλο-σιλάνιο. Αυτά τα μονομερή λαμβάνονται μέσω της αντίδρασης μεταξύ πυριτίας, που υπάρχει κυρίως στην άμμο, με άνθρακα οπτάνθρακα, για να ληφθεί πρώτα πυρίτιο:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
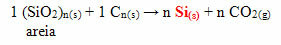
Το επόμενο βήμα είναι η αντίδραση αυτού του πυριτίου που λαμβάνεται με μεθυλοχλωρίδιο ή με φαινυλοχλωρίδιο για να σχηματιστεί ένα από τα δύο μονομερή που αναφέρονται παραπάνω:
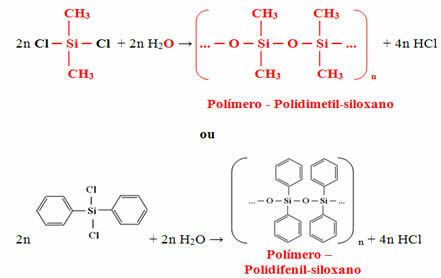
Το μονομερές που λαμβάνεται τελικά θα αντιδράσει με νερό για να σχηματίσει το πολυμερές (σιλικόνη) και θα απελευθερώσει υδροχλωρικό οξύ ως υποπροϊόν:
Η σιλικόνη είναι ένα πολύ σταθερό πολυμερές και έχει μεγάλη αντοχή στη θερμότητα, καθώς μόνο οι οργανικές ενώσεις που συνδέονται με τη σιλικόνη αρχίζουν να καίγονται σε επαφή με τη θερμότητα. Ωστόσο, όταν αυτές οι ρίζες έχουν τελειώσει την αντίδραση, παραμένει μόνο σίλικα (άμμος), η οποία εμποδίζει τη συνέχιση της καύσης.
Επειδή έχει αυτά τα χαρακτηριστικά, είναι μη τοξικό, έχει μεγάλη χημική αδράνεια και εμφανίζεται με τρόπους που διαφέρουν από το εξαιρετικά ρευστό υγρό έως καουτσούκ στερεό, αυτά τα πολυμερή χρησιμοποιούνται στις πιο διαφορετικές περιοχές. Παρακάτω είναι μερικές από αυτές τις εφαρμογές:

Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Σιλικόνη - σύσταση και εφαρμογές". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/silicone-constituicao-aplicacoes.htm. Πρόσβαση στις 28 Ιουνίου 2021.