Για να καταλάβετε το φαινόμενο του ιονισμός είναι πρώτα απαραίτητο να γνωρίζουμε τι είναι τα ιόντα. Σημειώστε την εξήγηση παρακάτω:
Κάθε άτομο έχει τον ίδιο αριθμό πρωτονίων και ηλεκτρονίων. Επομένως, κάθε άτομο είναι ηλεκτρικά ουδέτερο. Επιπλέον, οι ουσίες που σχηματίζονται από ομάδες ατόμων έχουν επίσης μια ισορροπία ηλεκτρικού φορτίου, που είναι ηλεκτρικά ουδέτερες.
Ωστόσο, ένα άτομο ή μια ομάδα ατόμων μπορεί να χάσει ή να αποκτήσει ηλεκτρόνια. όταν συμβεί αυτό, χάνουν ουδετερότητα και γίνονται ιόντα.
Εάν το άτομο ή η ομάδα ατόμων χάσει ηλεκτρόνια, θα φορτιστεί θετικά και θα ονομάζεται ιόν κατιόν. Ωστόσο, εάν αποκτήσετε ηλεκτρόνια, το φορτίο θα είναι αρνητικό και το ιόν θα είναι α ανιόν.
Οι ανόργανες ουσίες είναι ιονικές ή έχουν την ικανότητα να σχηματίζουν ιόντα.
Ένας από τους τρόπους σχηματισμού ιόντων είναι η τοποθέτηση μοριακών ουσιών στο νερό, δηλαδή σχηματίζεται από ομοιοπολικούς δεσμούς, στους οποίους τα ηλεκτρόνια μοιράζονται.
Για παράδειγμα, εάν δοκιμάσουμε την ηλεκτρική αγωγιμότητα του υδροχλωρικού οξέος (HCl) σε υδατικό διάλυμα (υδροχλώριο διαλυμένο σε νερό), θα δούμε ότι η λύση είναι ηλεκτρολυτική, δηλαδή, διεξάγει ηλεκτρικό ρεύμα, επειδή υπάρχουν ιόντα σε αυτό λύση.

Αυτό σημαίνει ότι το νερό έδρασε ως αντιδραστήριο, σχηματίζοντας ιόντα από υδροχλωρικό οξύ. Αυτό συμβαίνει σύμφωνα με την παρακάτω αντίδραση:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
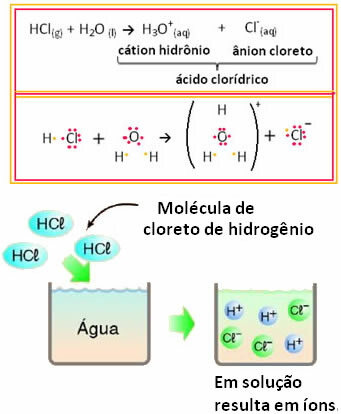
Σημειώστε ότι πριν βάλετε υδροχλώριο στο νερό, δεν υπήρχαν ιόντα. Ωστόσο, τα μόρια του αντέδρασαν με νερό και σχηματίζουν θετικά ιόντα Η3Ο+ (κατιόντα) και αρνητικά Cl- (ανιόντα). Δεδομένου ότι το χλώριο είναι περισσότερο ηλεκτροαρνητικό από το υδρογόνο, προσελκύει το ζεύγος ηλεκτρονίων από τον ομοιοπολικό δεσμό κοντά του και σχηματίζει το ανιόν. Το υδρογόνο, από την άλλη πλευρά, προσελκύεται από οξυγόνο στο νερό, το οποίο είναι περισσότερο ηλεκτροαρνητικό από το χλώριο. και μεταξύ υδρογόνου και οξυγόνου σχηματίζεται ένας ομοιοπολικός δεσμός, δημιουργώντας το κατιόν υδρονίου. Αυτό το φαινόμενο σχηματισμού ιόντων ονομάζεταιιονισμός.
Με βάση την παραπάνω εξήγηση, μπορούμε να ορίσουμε τον ιονισμό ως εξής:

Σημειώστε ότι τα ιόντα δεν υπήρχαν στο παρελθόν, γιατί εάν υπήρχαν, όπως στην περίπτωση της διάλυσης των ιοντικών ενώσεων, θα είχαμε μια ιοντική διάσταση και όχι έναν ιονισμό.
Όλα τα οξέα που έρχονται σε επαφή με νερό υφίστανται ιονισμό. Ωστόσο, δεν υφίσταται ιονισμός κάθε μοριακή ένωση.Για παράδειγμα, η ζάχαρη (C12Η22Ο11είναι μοριακό, ωστόσο, όταν τοποθετούνται σε νερό, δεν σχηματίζονται ιόντα, διαλύεται απλώς, δημιουργώντας ένα μη ηλεκτρολυτικό μοριακό διάλυμα, το οποίο δεν αγωγεί ηλεκτρισμό.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ιονισμός"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Πρόσβαση στις 28 Ιουνίου 2021.