Kps είναι το ακρωνύμιο που χρησιμοποιείται για την αναπαράσταση σταθερά προϊόντος διαλυτότητας, το οποίο αναφέρεται στο προϊόν (πολλαπλασιασμός) του συγκεντρώσεις σε ποσότητα ύλης των ιόντων που υπάρχουν σε ένα διάλυμα.
Όποτε προστίθεται μια ελάχιστα διαλυτή διαλυμένη ουσία σε έναν διαλύτη όπως θειικό βάριο, μια μικρή ποσότητα μέρος αυτού του αλατιού διαλύεται στο νερό, και το υπόλοιπο συσσωρεύεται στον πυθμένα του δοχείου, σχηματίζοντας το σώμα Ιστορικό. Το αλάτι που διαλύεται υποφέρει διάσταση, απελευθερώνοντας κατιόντα και ανιόντα στο νερό.

Το ίζημα υπάρχει σε διάλυμα με νερό και θειικό βάριο
Εκτός αυτού το αλάτι δεν παρουσιάζει καλό διαλυτότητα, η ποσότητα της διαλυμένης διαλυμένης ουσίας δεν αλλάζει με την πάροδο του χρόνου επειδή υπάρχει ισορροπία διάλυσης μεταξύ των ιόντων άλατος (που υπάρχουν στο διάλυμα) και του σώματος του υποβάθρου.

Υπόλοιπο διάλυσης BaSO4 στο νερό
Kps διαλυμένης ουσίας
Ο Kps μιας διαλυμένης ουσίας είναι το προϊόν των μοριακών συγκεντρώσεων των συμμετεχόντων ιόντων. Είναι πάντα απαραίτητο να αυξηθεί η συγκέντρωση ιόντων στον αντίστοιχο στοιχειομετρικό συντελεστή του (χρησιμοποιείται για την εξισορρόπηση της εξίσωσης).

Ισορροπία διάλυσης ηλεκτρολύτη ΥοΧσι
Ο Kps της προτεινόμενης ισορροπίας για το άλας ΥοΧσι θα έχει τη συγκέντρωση του αντιδραστηρίου Υ (αυξάνεται στον στοιχειομετρικό συντελεστή του (α) και τη συγκέντρωση του προϊόντος Χ (αυξάνεται στον στοιχειομετρικό συντελεστή του (b)).
Kps = [Υ+ β]ο.[Χ-Ο]σι
Παράδειγμα
Ας υποθέσουμε ότι ετοιμάζουμε μια λύση με νερό και κυανιούχο αλουμίνιο [Al (CN)3], το οποίο είναι πρακτικά αδιάλυτο αλάτι στο νερό. Όταν αυτό το αλάτι προστίθεται στο νερό, καταλήγει να υποφέρει το φαινόμενο της αποσύνδεσης.

Ισορροπία διάλυσης ηλεκτρολυτών Al (CN)3
Έτσι, μέσω της εξίσωσης της ισορροπίας της διάλυσης άλατος, το έχουμε αυτό Kps θα έχει τον πολλαπλασιασμό της συγκέντρωσης του κατιόντος αλουμινίου (Al+3) αυξήθηκε στον εκθέτη 1 με τη συγκέντρωση ανιόντος κυανιδίου (CN-1) έθεσε σε εκθετικό 3.
Kps = [Αλ+3]1[CN-1]3
Kps σημασίες μιας διαλυμένης ουσίας
Όταν βρούμε το Kps ενός συγκεκριμένου αλατιού αναμεμιγμένου με νερό, γνωρίζουμε επίσης τη συγκέντρωση καθενός από τα ιόντα στο διάλυμα. Με αυτά τα δεδομένα, μπορούμε να προσδιορίσουμε την κατάταξη μιας λύσης ή τη συμπεριφορά της διαλυμένης ουσίας στη λύση. Εξετάστε το ακόλουθο υπόλοιπο:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)

Ισορροπία διάλυσης ηλεκτρολύτη ΥοΧσι
Μπορούμε να κάνουμε τις ακόλουθες σχέσεις:
Εάν Kps = [Y+ β]ο.[Χ-Ο]σι = 0, έχουμε ένα κορεσμένο διάλυμα χωρίς την παρουσία ιζήματος.
Εάν Kps> [Y+ β]ο.[Χ-Ο]σι = 0, έχουμε ένα ακόρεστο διάλυμα, δηλαδή μια χαμηλή ποσότητα διαλυμένης ουσίας διαλυμένη στον διαλύτη (σε σχέση με συντελεστής διαλυτότητας);
Εάν Kps + β]ο.[Χ-Ο]σι = 0, έχουμε ένα κορεσμένο διάλυμα με το κάτω μέρος του σώματος, δηλαδή, θα υπάρξει καθίζηση του ηλεκτρολύτη (διαλυμένη ουσία).
Εάν η τιμή Kps του ηλεκτρολύτη είναι πολύ χαμηλή, είναι ένα ελάχιστα διαλυτό υλικό στον διαλύτη.
Παράδειγμα του Υπολογισμός Kps μιας διαλυμένης ουσίας
(UERN): Η διαλυτότητα του νιτρικού ασβεστίου [Ca (NO3)2] στο νερό είναι 2,0. 10–3 mol / λίτρο σε μια συγκεκριμένη θερμοκρασία. Το Kps αυτού του αλατιού στην ίδια θερμοκρασία είναι:
α) 8.10–8.
β) 8.10–10.
γ) 3.2.10–10
δ) 3.2.10–8
Δεδομένα άσκησης:
Τύπος αλατιού: Ca (ΟΧΙ3)2;
Συγκέντρωση μοριακού άλατος (διαλυτότητα): 2.0. 10–3 φίλη αλήτη.
Για να επιλύσετε και να υπολογίσετε το Kps, πρέπει να κάνετε τα εξής:
Βήμα 1: Ρυθμίστε το ισοζύγιο διάλυσης αλατιού.
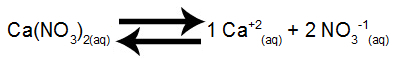
Ισορροπία διάλυσης νιτρικού ασβεστίου στο νερό
Το νιτρικό ασβέστιο, όταν υποβάλλεται σε διαχωρισμό στο νερό, απελευθερώνει 1 mol κατιόντων ασβεστίου (Ca+2) και 2 mol νιτρικών ανιόντων (ΟΧΙ3-1).
Βήμα 2: Συγκεντρώστε την έκφραση του Kps του αλατιού
Το Kps αυτού του άλατος θα είναι το προϊόν της συγκέντρωσης κατιόντος ασβεστίου που αυξάνεται στον εκθέτη 1 με τη συγκέντρωση του νιτρικού ανιόντος που αυξάνεται στον εκθέτη 2, όπως φαίνεται παρακάτω:
Kps = [Ca+2]1.[ΣΤΟ3-1]2
Βήμα 3: Προσδιορίστε τις τιμές των συγκεντρώσεων ιόντων στο διάλυμα
Για τον υπολογισμό του Kps, χρειαζόμαστε τις τιμές των συγκεντρώσεων ιόντων, ωστόσο, η άσκηση παρείχε τη μοριακότητα του άλατος στο διάλυμα. Για να προσδιορίσετε τη συγκέντρωση κάθε ιόντος, πολλαπλασιάστε απλά τη μοριακότητα του άλατος με το στοιχειομετρικό συντελεστή του συμμετέχοντα στην αντίδραση:
Για κατιόν ασβεστίου:
[Εδώ+2] = 1. 2,0. 10–3
[Εδώ+2] = 2,0. 10–3 φίλη αλήτη
Για το νιτρικό ανιόν:
[ΣΤΟ3-1] = 2. 2,0. 10–3
[ΣΤΟ3-1] = 4,0. 10–3 φίλη αλήτη
Βήμα 4: Χρησιμοποιήστε τις τιμές συγκέντρωσης που βρίσκονται στο βήμα 3 στην έκφραση Kps (προσδιορίζεται στο βήμα 2).
Kps = [Ca+2]1.[ΣΤΟ3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2,10-3.16.10-6
Kps = 32.10-9
ή
Kps = 3.2.10-9 (mo / L)
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Τι είναι το Kps;"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm. Πρόσβαση στις 27 Ιουνίου 2021.
Τι είναι η χημεία;

Κατανοήστε τι είναι το Kp, η σταθερά ισορροπίας ως προς την πίεση και μάθετε πώς να το αποκτήσετε χρησιμοποιώντας πιέσεις μερίδια όλων των αερίων που υπάρχουν σε χημική ισορροπία, η οποία μπορεί να είναι σε ατμόσφαιρες (atm) ή χιλιοστά υδραργύρου (mmHg). Κάντε κλικ εδώ και μάθετε περισσότερα για αυτό το θέμα!