Στο διαμοριακές δυνάμεις είναι ένα θέμα στη Χημεία που, σίγουρα, μπορεί να εμφανιστεί στις Εξετάσεις Εθνικού Λυκείου (Και είτε). Επομένως, αξίζει να δείτε τα κύρια περιεχόμενα αυτού του θέματος σε αυτό το άρθρο.
Ορισμός
διαμοριακές δυνάμεις Είναι δυνάμεις - διαφορετικών εντάσεων (ασθενής, μέτριας ή ισχυρής) - ηλεκτροστατικής έλξης ή δεσμών που δημιουργούνται μεταξύ των μορίων μιας ουσίας που διατηρούν την ένωση μεταξύ τους.
Τύποι διαμοριακών δυνάμεων
Ο) Προκαλούμενο δίπολο
Και το διαμοριακή δύναμη που συμβαίνει μεταξύ των μορίων μιας ουσίας με μη πολικό χαρακτηριστικό. Συμβαίνει, για παράδειγμα, μεταξύ μορίων ουσιών όπως το Ο2Χ2, όχι2, CO2, CH4.
Η ένωση μεταξύ αυτών των μορίων εμφανίζεται όταν δημιουργείται δίπολο μεταξύ τους. Αυτό συμβαίνει όταν τα ηλεκτρόνια ενός μορίου εκτοπίζουν τα ηλεκτρόνια ενός άλλου, δημιουργώντας έτσι έναν αρνητικό και θετικό πόλο, ο οποίος μεταφέρεται από το ένα μόριο στο άλλο.
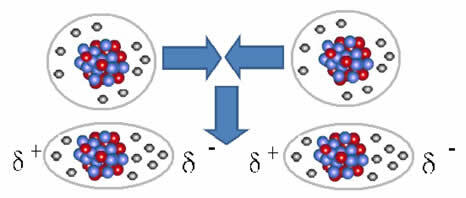
Αναπαράσταση του σχηματισμού διπόλων σε μη πολικά μόρια
Μεταξύ αυτών των μορίων σχηματίστηκαν δύο πόλοι και ο αρνητικός πόλος του ενός αλληλεπιδρά με τον θετικό πόλο του άλλου. Επειδή αυτοί οι πόλοι δημιουργήθηκαν, είναι μια ενδομοριακή δύναμη χαμηλής έντασης.
ΣΙ) μόνιμο δίπολο
Και το διαμοριακή δύναμη που συμβαίνει μεταξύ των μορίων μιας ουσίας με πολικό χαρακτηριστικό. Παραδείγματα είναι μόρια ουσιών όπως HCN, H2Ο, ΝΗ3, CO, CH3Κλ.
Η ένωση μεταξύ αυτών των μορίων συμβαίνει όταν ο αρνητικός πόλος του ενός αλληλεπιδρά με τον θετικό πόλο του άλλου.
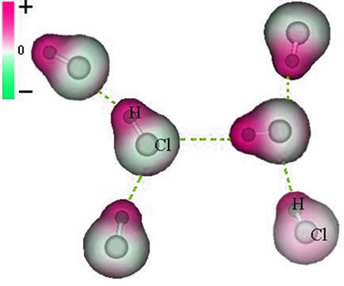
Αναπαράσταση της μόνιμης διπολικής δύναμης μεταξύ των μορίων HCl
Καθώς υπάρχουν ήδη οι πόλοι, η μόνιμη διαμοριακή διπολική δύναμη έχει μεγαλύτερη ένταση από την επαγόμενη διπολική.
ντο) δεσμοί υδρογόνου
Οτι διαμοριακή δύναμη Εμφανίζεται μεταξύ πολικών μορίων που έχουν άτομο υδρογόνου συνδεδεμένο απευθείας σε άτομο οξυγόνου, αζώτου ή φθορίου.
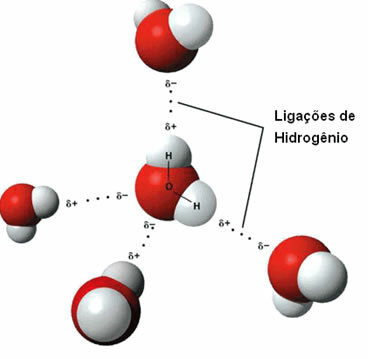
Αναπαράσταση δεσμών υδρογόνου μεταξύ μορίων νερού
Ένας δεσμός υδρογόνου σχηματίζεται όταν το υδρογόνο σε ένα μόριο αλληλεπιδρά με το οξυγόνο, άζωτο ή φθόριο του άλλου μορίου.
δ) διπολικό ιόν
Αυτή η διαμοριακή δύναμη εμφανίζεται ανάμεσα σε ένα πολικό μόριο, το οποίο έχει ένα ζεύγος ηλεκτρονίων που δεν συνδέονται, και ένα ιόν (κατιόν ή ανιόν) στο διάλυμα.
Το μόριο νερού, για παράδειγμα, έχει δύο ζεύγη μη δεσμευτικών ηλεκτρονίων σε οξυγόνο. Εάν υπάρχουν ιόντα στο υδατικό μέσο, πλησιάζουν το μόριο του νερού, καθώς υπάρχουν πόλοι σε αυτό.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Σημασια
Η σημασία της γνώσης του διαμοριακές δυνάμεις για το Enem Είναι η κατανόηση που φέρνουν σχετικά με τις φυσικές καταστάσεις, το σημείο τήξης, το σημείο βρασμού και τη διαλυτότητα των ουσιών.
Ο) Σχέση με το σημείο τήξης και βρασμού της ουσίας
Το σημείο τήξης υποδεικνύει τη θερμοκρασία της μετάβασης από στερεό σε υγρή κατάσταση και το σημείο βρασμού δείχνει τη θερμοκρασία μετάβασης από υγρό σε αέρια κατάσταση.
Αυτό το απόσπασμα σχετίζεται άμεσα με την αλληλεπίδραση μεταξύ των μορίων της ουσίας, καθώς αυτό που διαφοροποιεί μια φυσική κατάσταση από την άλλη είναι το επίπεδο συσσωμάτωσης μεταξύ των μορίων της.
Έτσι, όσο πιο έντονη είναι η διαμοριακή δύναμη, τόσο υψηλότερα είναι τα σημεία τήξης και βρασμού. Όσο λιγότερο έντονη είναι η διαμοριακή δύναμη, τόσο χαμηλότερα είναι τα σημεία τήξης και βρασμού. Έτσι, μπορούμε να καθορίσουμε την φθίνουσα σειρά του σημείου τήξης και βρασμού:
Δεσμός υδρογόνου> μόνιμο δίπολο> επαγόμενο δίπολο
ΣΙ) Σχέση με τη διαλυτότητα
Γενικά, πρέπει να γνωρίζουμε ότι όπως τα διαλύματα όπως, δηλαδή, η πολική ουσία διαλύει την πολική ουσία και η μη πολική ουσία διαλύει τη μη πολική ουσία.
Ωστόσο, υπάρχει ακόμη η δυνατότητα αλληλεπίδρασης μεταξύ των μορίων διαλυμένης ουσίας και των μορίων του διαλύτη. Αυτό συμβαίνει μόνο εάν αυτή η νέα αλληλεπίδραση είναι μεγαλύτερη από αυτήν που υπάρχει ήδη μεταξύ των μορίων της ίδιας της ουσίας.
Παράδειγμα εφαρμογής διαμοριακής δύναμης στο Enem
1ο Παράδειγμα: (Enem-2011) Το ανθρώπινο δέρμα, όταν είναι καλά ενυδατωμένο, αποκτά καλή ελαστικότητα και απαλή και απαλή εμφάνιση. Από την άλλη πλευρά, όταν είναι ξηρό, χάνει την ελαστικότητά του και φαίνεται αδιαφανές και τραχύ. Για να αποφευχθεί η ξηρότητα του δέρματος, είναι απαραίτητο, όποτε είναι δυνατόν, να χρησιμοποιήσετε ενυδατικά ενυδατικά, γενικά κατασκευασμένα από γλυκερίνη και πολυαιθυλενογλυκόλη:

Η κατακράτηση νερού στην επιφάνεια του δέρματος που προωθείται από τους ενυδατικούς παράγοντες είναι συνέπεια της αλληλεπίδρασης των υδροξυλομάδων των παραγόντων διαβροχής με την υγρασία που περιέχεται στο περιβάλλον μέσω:
α) ιοντικούς δεσμούς
β) δυνάμεις του Λονδίνου
γ) ομοιοπολικοί δεσμοί
δ) δυνάμεις διπόλου-διπολίου
ε) δεσμούς υδρογόνου
Η απάντηση σε αυτό το ερώτημα είναι σύνδεση υδρογόνου, καθώς το μόριο νερού έχει δεσμευτεί υδρογόνο σε άτομο οξυγόνου. Το ίδιο συμβαίνει και με τα μόρια προπυλενογλυκόλης και πολυαιθυλενογλυκόλης, μια ευνοϊκή συνθήκη για την εμφάνιση αυτού του τύπου διαμοριακής δύναμης.
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Διαμοριακές δυνάμεις στο Enem" Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Πρόσβαση στις 27 Ιουνίου 2021.