Η ομοιοπολική σύνδεση συμβαίνει όταν δύο άτομα μοιράζονται ζεύγη ηλεκτρονίων για να αποκτήσουν τη διαμόρφωση ηλεκτρονίων ενός ευγενές αέριο (με 8 ηλεκτρόνια στο κέλυφος σθένους ή με 2, στην περίπτωση εκείνων με μόνο το κέλυφος Κ), σύμφωνα με τον κανόνα του οκταφωνία.
Ωστόσο, υπάρχουν ειδικές περιπτώσεις ομοιοπολικών δεσμών στις οποίες το κοινό ζεύγος ηλεκτρονίων προέρχεται μόνο από ένα από τα άτομα που είναι ήδη σταθερά. Προηγουμένως, αυτό το είδος ομοιοπολικού δεσμού ονομάστηκε δοτική πτώση, σήμερα ονομάζεται πιο συχνά συντεταγμένη.
Δείτε μερικά παραδείγματα για να καταλάβετε πώς συμβαίνει αυτό:
- CO (μονοξείδιο του άνθρακα):
Ο άνθρακας έχει 4 ηλεκτρόνια στο κέλυφος του σθένους. Επομένως, σύμφωνα με τον κανόνα οκτάδας, για να είναι σταθερό, πρέπει να λάβει 4 ακόμη ηλεκτρόνια, συνολικά 8. Το οξυγόνο, από την άλλη πλευρά, έχει 6 ηλεκτρόνια στο κέλυφος σθένους και πρέπει να λάβει 2 ηλεκτρόνια για να πάρει τη διαμόρφωση του νέου ευγενούς αερίου.
Έτσι, πρώτα, ο άνθρακας και το οξυγόνο μοιράζονται δύο ζεύγη ηλεκτρονίων έτσι ώστε το οξυγόνο να είναι σταθερό:
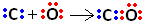
Ωστόσο, ο άνθρακας παραμένει ασταθής καθώς έχει ακόμα 6 ηλεκτρόνια και χρειάζεται 2. Επομένως, το οξυγόνο, το οποίο είναι ήδη σταθερό, μοιράζεται ένα από τα ζεύγη ηλεκτρονίων του με άνθρακα, δηλαδή, δημιουργεί έναν εγγενή δεσμό μαζί του, καθιστώντας το σταθερό:

Σημειώστε ότι ο ομοιοπολικός δεσμός συντεταγμένων μπορεί να αναπαρασταθεί με μια παύλα, όπως και ο κοινός ομοιοπολικός δεσμός.
- ΜΟΝΟ2 (Διοξείδιο του θείου):
Κάθε άτομο θείου και οξυγόνου έχει 6 ηλεκτρόνια στα κελύφη σθένους τους, οπότε πρέπει να δέχονται 2 ηλεκτρόνια το καθένα. Αρχικά, το θείο δημιουργεί δύο κοινούς ομοιοπολικούς δεσμούς, που μοιράζονται δύο ζεύγη ηλεκτρονίων με ένα από τα άτομα οξυγόνου, και τα δύο παραμένουν σταθερά με 8 ηλεκτρόνια.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Όμως, το άλλο άτομο οξυγόνου δεν είναι σταθερό, οπότε το θείο μοιράζεται μαζί του ένα ζευγάρι των ηλεκτρονίων του μέσω ενός συντονισμένου ή αφαιρετικού ομοιοπολικού δεσμού:
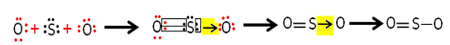
Σημειώστε ότι σε αυτήν την περίπτωση έχουμε τρία άτομα στο μόριο, οπότε μπορεί να υπάρξει μετανάστευση του δεσμού από το ένα άτομο στο άλλο. Το μόριο διοξειδίου του θείου μπορεί επίσης να αναπαρασταθεί ως εξής: O ─ S ═ O.
Αυτό το αποκαλούμε φαινόμενο συγκόλλησης απήχηση. Δείτε τρία ακόμη παραδείγματα στον παρακάτω πίνακα:
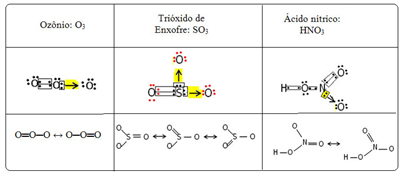
Οι πιθανές δομές ονομάζονται δομές συντονισμού ή κανονικές μορφές.
Αυτός ο τύπος δεσμού εμφανίζεται επίσης στο σχηματισμό ιόντων, όπως στην περίπτωση των ιόντων υδρονίου (Η3Ο+) και αμμώνιο (NH4+).
Πρώτον, το Η κατιόν+ σχηματίζεται όταν το υδρογόνο χάνει το μοναδικό του ηλεκτρόνιο, αφήνοντάς το με θετικό φορτίο. Επομένως, θα πρέπει να λάβει δύο ηλεκτρόνια για να είναι σταθερά. Αυτό συμβαίνει μέσω ενός αρχικού δεσμού με το νερό (στην περίπτωση του ιόντος υδρονίου) και με την αμμωνία (στην περίπτωση του ιόντος αμμωνίου). Παρακολουθώ:

Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Dative ή Coordated Covalent Bonding". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Πρόσβαση στις 28 Ιουνίου 2021.



