Η οργανική ομάδα αλκοολών είναι πολύ γνωστή στην Οργανική Χημεία, χαρακτηριζόμενη από την παρουσία ενός υδροξυλίου (ΟΗ) συνδεδεμένου με έναν κορεσμένο άνθρακα. Υπάρχουν αλκοόλες που είναι ακόρεστα, όπως το but-3-en-1-ol παρακάτω:
Η2C ═ CH ─ CH2 Χ.Χ.2 ─ ω
Ωστόσο, ορισμένες ενώσεις έχουν το υδροξυλ απευθείας συνδεδεμένο με άνθρακα με διπλό δεσμό. Αυτός ο τύπος ένωσης δεν είναι αλκοόλ, ανήκει στην οργανική λειτουργία που ονομάζεται: ενολ.
Οι ενόλες, επομένως, χαρακτηρίζονται από την ακόλουθη λειτουργική ομάδα:
│
─ C ═ CH ─ ω
Η ονοματολογία των ενόλων γίνεται σύμφωνα με το ακόλουθο σχήμα:
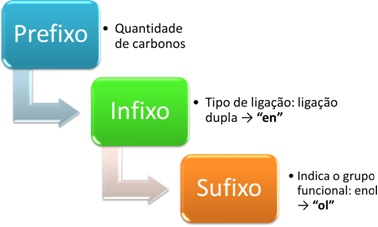
Για παράδειγμα, σκεφτείτε το ακόλουθο απλούστερο enol:
Η2Γ CH ─ ω
Πρόθεμα: έχει 2 άνθρακες: κ.ά.
Infix: διπλός δεσμός: en → αιθυλένιο
Επίθημα: enol: γεια
Στην περίπτωση της αιθενόλης, δεν ήταν απαραίτητο να αριθμηθεί η θέση της λειτουργικής ομάδας ή ακόρεστος επειδή δεν υπήρχε άλλη πιθανότητα. Όμως, στις παρακάτω περιπτώσεις, είναι απαραίτητο:
Η3C─ CH═CH ─ ΟΗ: prop-1-en-1-ol
Η3C─C═CH2: προπ-1-εν-2-όλη
│
Ω
Η3C─ CH═C Χ.Χ.2 Χ.Χ.3: pent-2-en-3-όλη
│
Ω
Η3C─C═CH Χ.Χ.3: αλλά-2-εν-2-όλη
│
Ω
Οι ενόλες είναι πολύ ασταθείς ενώσεις, καθώς μπορούν να περάσουν από έναν τύπο δυναμικού ισομερισμού που ονομάζεται ταυτομετρική, στον οποίο τα ισομερή συνυπάρχουν σε δυναμική ισορροπία στην ίδια υγρή φάση.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Το οξυγόνο σε ένα ενολί είναι πολύ ηλεκτροαρνητικό, το οποίο προσελκύει τα ηλεκτρόνια από τον διπλό δεσμό του άνθρακα, που είναι ένας ασθενής δεσμός που είναι εύκολο να εκτοπιστεί, σχηματίζοντας μια αλδεΰδη ή μια κετόνη.
Για παράδειγμα, σε διάλυμα οξικής αλδεΰδης (αιθανόλη), ένα μικρό μέρος μετατρέπεται σε αιθενόλη, η οποία με τη σειρά της αναγεννάται ξανά σε αλδεΰδη. Έτσι, υπάρχει μια χημική ισορροπία μεταξύ αυτών των ενώσεων που έχουν τον ίδιο μοριακό τύπο C2Η4Ο:
Αιθανική αιθανόλη
Ω
║ │
Η3ΝΤΟ - Ç - Η ↔ Η2ΝΤΟ ═ Γ - Η
ενόλη αλδεΰδη
Ένα άλλο enol, prop-1-en-2-ol, μπορεί να εισέλθει σε δυναμική ισορροπία με κετόνη, προπανόνη:
Προπανόνη Prop-1-en-2-ol
ΩΧ ΩΧ
║ │ │
Η3C - C - C - H ↔ Η2ΝΤΟ ═ Γ - ΧΗ2
ενόλη κετόνη
Για περισσότερες λεπτομέρειες, διαβάστε το κείμενο: Δυναμική συνταγματική ισομετρική ή ταυτομετρία.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Enols και η ονοματολογία του" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/enois-sua-nomenclatura.htm. Πρόσβαση στις 27 Ιουνίου 2021.
Χημεία

Αποκτήστε πρόσβαση σε αυτόν τον σύνδεσμο και μάθετε για την οργανική λειτουργία των φαινολών, μιας ομάδας οξυγονωμένων ουσιών από μεγάλη αντιδραστικότητα, της οποίας η οξύτητα είναι μεγαλύτερη από αυτήν των αλκοολών (ενώσεις που έχουν επίσης μια ομάδα υδροξύλιο). Η δομή του ξεχωρίζει για την παρουσία μιας ομάδας υδροξειδίου (ΟΗ) που συνδέεται άμεσα με μια αρωματική ένωση.
Κύριες φαινόλες, ασπιρίνη, πικρικό οξύ, βακελίτες, απωθητική ιδιότητα φαινολοφθαλεΐνης κρεσόλη, κρεολίνη, λυσόλη, κρεσόλες, λάδι που λαμβάνεται από πίσσα άνθρακα, κατασκευή συντηρητικών για ξύλο.
Χημεία
Μάθετε ποιοι είναι οι διάφοροι τύποι επίπεδων και χωρικών ισομερών, όπως λειτουργία, θέση, αλυσίδα, ταυτομερισμός, μεταμερισμός, γεωμετρικός και οπτικός ισομερισμός.
Χημεία

Λειτουργική ομάδα υδροξυλίου, πρωτοταγείς αλκοόλες, δευτερογενείς αλκοόλες, τριτοταγείς αλκοόλες, μεθανόλη, γλυκερόλη, αιθανόλη, παρασκευή νιτρογλυκερίνης, παραγωγή χρωμάτων, παραγωγή αλκοολούχων ποτών, οξικό οξύ, καύσιμο αυτοκίνητα.