DAS Clapeyron-Gleichung ist ein mathematischer Ausdruck, der Größen wie Druck (P), Volumen (V), Temperatur (T) und die Anzahl der Teilchen (n), aus denen a. besteht perfektes oder ideales Gas. Diese Gleichung ist nach dem französischen Physiker benannt PaulEmilieclapeyron und kann als Verallgemeinerung der empirischen Gesetze der GaseperfektimGay-Lussac, Charles und Boyle. Es war grundlegend für das Studium idealer Gase und ermöglichte die Entwicklung von Thermische Maschinen, was sie in den letzten Jahrzehnten immer effizienter gemacht hat.
Auch sehen: Physikalische Entdeckungen, die durch einen Unfall geschahen
Clapeyron-Gleichung: Ideales Gasgesetz
Clapeyrons Gleichung lautet abgeleitet von drei empirischen Gesetzend.h. Gesetze, die aus Experimenten ermittelt wurden. Solche Gesetze erklären das Verhalten von Gasen in Gasumwandlungenisovolumetrisch (Gay-Lussac-Gesetz), isobar (Charles-Gesetz) und Isothermen (Boyles Gesetz). Nach diesen Gesetzen:
in den Verwandlungen isovolumetrisch, das Verhältnis zwischen Druck und thermodynamischer Temperatur eines idealen Gases bleibt konstant;
in den Verwandlungen isobar, das Verhältnis zwischen Volumen und thermodynamischer Temperatur eines idealen Gases ist konstant;
- in den Verwandlungen Isothermen, bleibt das Produkt aus Druck und Volumen eines idealen Gases konstant.
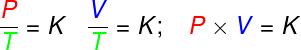
P – Druck (Pa – Pascal)
V – Gasvolumen (m³)
T – thermodynamische Gastemperatur (K – Kelvin)
Aus den drei obigen Gesetzen bestimmt die Clapeyron-Gleichung den Wert dieser Konstante (K) in jeder der oben genannten Transformationen erhalten. Nach der Clapeyron-Gleichung ist diese Konstante gleich der Anzahl der Mole multipliziert mit a Konstante R, bekannt als universelle Konstante idealer Gase und gleich Boltzmann-Konstante multipliziert mit Avogadros Nummer.
Formel
Schauen Sie sich die Formel an, die als. bekannt ist GleichungimClapeyron:
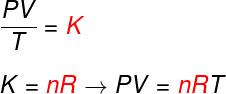
Nein – Molzahl (Mol)
R – universelle Konstante idealer Gase (R = 0,082 atm.l/mol. K oder 8,314 J.mol/K)
Die Analyse der Clapeyron-Gleichung zeigt, dass die Druck von idealen Gasen ausgeübt wird, ist direkt proportional zur Temperatur und auch zu Anzahl der Maulwürfe. Außerdem, Druck ist umgekehrt proportional zum Volumen mit Gas belegt.
Ö ideales Gasmodell die durch die Clapeyron-Gleichung ermöglicht wird, wird häufig für die Entwicklung von Maschinen powered by Flüssigkeiten, wie dampfbetriebene Maschinen und Verbrennungsmotoren.
Aus der Clapeyron-Gleichung konnten mehrere wichtige Ergebnisse gewonnen werden. Einer von ihnen sagt zum Beispiel voraus, dass 1 Mol eines idealen Gases ein Volumen von. einnimmt 22,4 Liter unter dem Druck von 1 atm (1,01.105 Pa) und bei der Temperatur von 273K (0°C).
Auch sehen: Die wichtigsten Konzepte in der Thermologie
Gelöste Übungen zur Clapeyron-Gleichung
Frage 1 – (UECE) Ein Gas, dessen Temperatur, Volumen und Druck durch PV = nRT bezogen werden kann, hat die folgenden Eigenschaften:
a) sehr großer durchschnittlicher Abstand zwischen Molekülen, um intermolekulare Wechselwirkungen außer bei Kollisionen zu vernachlässigen; Moleküle unterliegen elastischen Stößen.
b) sehr kleiner mittlerer Abstand zwischen Molekülen; Moleküle unterliegen unelastischen Stößen.
c) sehr großer mittlerer Abstand zwischen Molekülen, um intermolekulare Wechselwirkungen außer bei Kollisionen zu vernachlässigen; Moleküle unterliegen unelastischen Stößen.
d) sehr großer mittlerer Abstand zwischen Molekülen und mit starken intermolekularen Wechselwirkungen; Moleküle unterliegen elastischen Stößen.
Auflösung:
Im idealen Gasmodell bewegen sich viele dimensionslose Teilchen mit hoher Geschwindigkeit in zufällige Richtungen. Die einzige Wechselwirkung, die diese Teilchen erleiden, sind vollkommen elastische Stöße, daher ist die richtige Alternative alternative Buchstabe a.
Frage 2 – (UFRGS) Betrachten Sie die folgenden Aussagen über ideale Gase.
ICH. Die in der Zustandsgleichung enthaltene Konstante R für Gase pV = nRT hat für alle idealen Gase den gleichen Wert.
II. Gleiche Volumina verschiedener idealer Gase enthalten bei gleicher Temperatur und gleichem Druck die gleiche Anzahl von Molekülen.
III. Die durchschnittliche kinetische Energie der Moleküle eines idealen Gases ist direkt proportional zur absoluten Temperatur des Gases.
Welche sind richtig?
a) Nur ich
b) Nur II
c) Nur III
d) Nur I und II
e) I, II und III
Vorlage:
Schauen wir uns die Alternativen an:
ICH. richtig, daher heißt sie die universelle Konstante idealer Gase.
II. richtig. Wenn zwei ideale Gase den gleichen Druck, die gleiche Temperatur und das gleiche Volumen haben, ist nach der Clapeyron-Gleichung die Anzahl der Teilchen in diesen Gasen gleich.
III. richtig. Nach dem Energiegleichverteilungssatz ist die kinetische Energie von Teilchen in einem idealen Gas proportional zu seiner Temperatur.
Daher ist die richtige Alternative die Buchstabe e.
Frage 3 - (UFJF) Männer wie Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls und andere haben wichtige Studien über die Eigenschaften von Gasen entwickelt. Das Verhalten realer Gase ähnelt idealen Gasen bei niedrigen Druckbedingungen sowie Gasen, die in einem großen Volumen enthalten sind, und Gasen, die bei hohen Temperaturen gehalten werden. Betrachten Sie, dass in einem Laborexperiment ein Behälter des Volumens V vollständig geschlossen ist und 1 mol eines idealen Gases unter einem Druck von 4.0. enthält atm einer Ausdehnung bei einer konstanten Temperatur von 127 ° C ausgesetzt ist und dass das Verhalten dieses Gases das eines idealen Gases ist, wie in gezeigt Grafik.
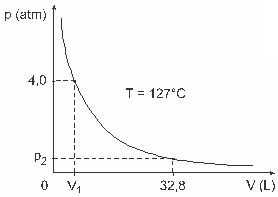
In diesem Fall, wenn das Gas ein Volumen von 32,8 l einnimmt, beträgt der von ihm ausgeübte Druck:
(Angegeben: Die universelle Konstante perfekter Gase ist R = 0,082 atm. L/Mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Auflösung:
Buchstabe C.
Um die Aufgabe zu lösen, müssen wir die Daten auf die Clapeyron-Gleichung anwenden, aber vorher müssen wir die Temperatur, die in Grad Celsius angegeben ist, in Kelvin umwandeln. Auschecken:

Von Rafael Hellerbock
Physik Lehrer
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm

