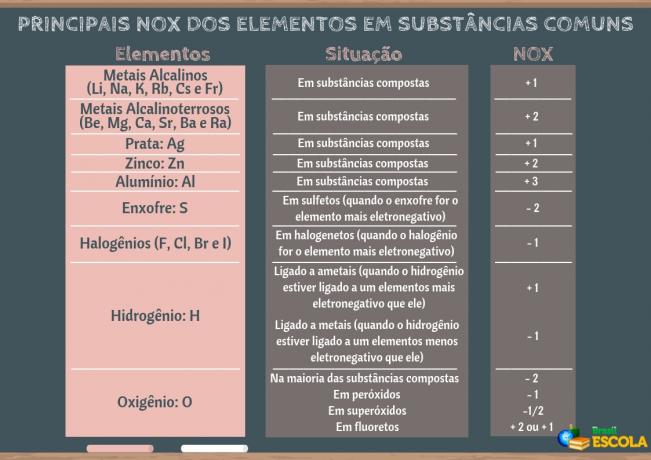
DAS Auto-Oxy-Reduktion oder disproportionale Reaktion ist eine Art Redoxreaktion, bei der das gleiche chemische Element Oxidation und Reduktion. Schauen wir uns zwei Beispiele für diese Art von Reaktion an und wie man sie mit der Redox-Methode ausbalanciert:
1. Beispiel:
BEI DER2- + H+ → NEIN3- + NEIN + H2Ö
- Durch Berechnung der Oxidationszahlen (NOX) aller an der Reaktion beteiligten Atome und Ionen lässt sich nachweisen, wer oxidiert und wer reagiert hat:
+3 -2 +1 +5 -2 +2 -2 +1 -2
BEI DER2- + H+ → NEIN3- + NEIN + H2Ö
- Beachten Sie, dass Stickstoff die Spezies war, die sowohl reagierte als auch oxidierte:
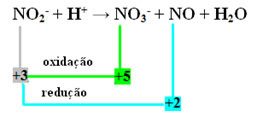
- Um diese Reaktion durch Redox auszugleichen, müssen wir die NOX auf die Produkte beziehen, nicht auf die Reagenzien:
BEI DER3- =∆Nox = 5 - 3 = 2
NO=∆Nox = 3 - 2 = 1
- Durch Invertieren von ∆NOX durch die Koeffizienten erhalten wir:
BEI DER3- =∆NOX= 2 → 2 wird der Koeffizient von NO. sein
NEIN=∆NOX= 1→ 1 wird der Koeffizient von NO. sein3-
BEI DER2- + H+ → 1 BEI DER3- + 2 NEIN+H2Ö
- Damit wissen wir bereits, dass das Produkt 3 N enthält, also der Koeffizient von NO2- wird 3:
3 NEIN2- + H+ → 1 NEIN3- + 2 Schließer + H2Ö
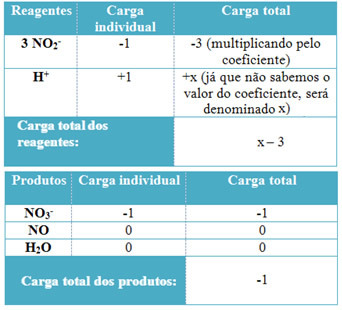
- Um die Koeffizienten von H. zu bestimmen+ und von H2O, denken Sie daran, dass die Anzahl der aufgenommenen Elektronen der gleichen Menge der abgegebenen Elektronen entspricht; somit ist die Reagenzienladung gleich der Produktladung. Auf diese Weise können wir das folgende Schema erstellen:
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Basierend auf diesen Informationen haben wir, dass die Gesamtladung der Reagenzien gleich x – 3 und das Produkt ist gleich -1. Wie gesagt, die Ladungen der beiden müssen gleich sein. Da wir bereits die Gesamtlast der Produkte haben, können wir eine einfache Berechnung durchführen, um den Wert von x zu ermitteln:
x -3 = -1
x = -1 +3
x = 2
Somit ist der Koeffizient von H+ ist 2 und folglich die von H2Das wird sein 1:
3 NEIN2- + 2 H+ → 1 NEIN3- + 2 NO + 1 H2Ö
2. Beispiel:
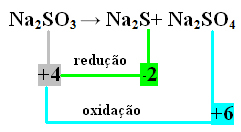
In diesem Fall wurde das S gleichzeitig reduziert und oxidiert. Auf diese Weise können wir, wie zuvor, NOX zu den Produkten in Beziehung setzen und ihre Werte invertieren, indem wir ihnen die Koeffizienten zuweisen:
Beim2 S=∆Nox = 4 – (-2) = 6 → 6 ist der Koeffizient von Na2 NUR4
Beim2 NUR4=∆Nox = 6 - 4 = 2 → 2 ist der Koeffizient von Na2 so
Beim2 NUR3→ 2 Beim2 Y+ 6 Beim2 NUR4
Da es im 2. Glied 8 Schwefelatome gibt, ist der Na-Koeffizient2 NUR3 wird 8 sein:
8 Zoll2 NUR3→ 2 Zoll2 S + 6 Zoll2 NUR4
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Selbstoxidationsreaktionen"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Zugriff am 28. Juni 2021.