Einer Additionsreaktion ist ein chemischer Prozess, bei dem Atome einer anorganischen Substanz zu einem organischen Molekül hinzugefügt werden, das eine der folgenden Eigenschaften aufweisen muss:
Offene Struktur mit Bindung oder pi-links;
Gesättigte geschlossene Struktur (nur mit Sigma-Links);
Geschlossene ungesättigte Struktur (mit einer pi- oder aromatischen Bindung).
Die organischen Verbindungen mit diesen Eigenschaften sind wie folgt Kohlenwasserstoffe:
Alkene;
Alkine;
Alkadiene;
Zyklane;
Fahrräder;
Aromaten.
Während eines Additionsreaktion, eine oder mehrere Pi-Bindungen oder eine Sigma-Bindung (im ausschließlichen Fall eines Cyclan) sind gebrochen wodurch zwei oder mehr freie Valenzen (Bindungsstellen) an den beteiligten Kohlenstoffen auftreten, wie im Beispiel unten:
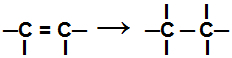
Brechen der Pi-Bindung in einem Alken
Nachdem diese Bindung gebrochen ist, muss die Anlagerung von Atomen an den neu geschaffenen Bindungsstellen in der organischen Verbindung erfolgen. Wir listen unten die Arten von Additionsreaktionen die mit organischen Verbindungen durchgeführt werden können.
Hydrierung
In diesem Additionsreaktion, neben der organischen Verbindung ist der andere Reaktant Wasserstoffgas (H2). In jedem der Kohlenstoffe, an denen die Spaltung stattfindet (Aufbrechen der Sigma- oder Pi-Bindung, wie zuvor gesehen), befindet sich die Bindung eines Wasserstoffatoms, die sich auf die Anzahl der aufgebrochenen Bindungen bezieht.
Wenn wir beispielsweise die Hydrierung von Cyclobutan durchführen, wird eine Sigma-Bindung zwischen den Kohlenstoffen 1 und 2 gebrochen. An jeden dieser Kohlenstoffe bindet dann ein Wasserstoffatom:
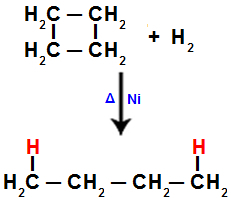
Gleichung für die Hydrierung in Cyclobutan
Halogenierung
Neben der organischen Verbindung ist das andere Reagens in diesem Additionsreaktion ist ein molekulares Halogen (Chlor-Cl-Gas2, Fluor-F-Gas2, festes Jod-I2 und flüssiges Brom-Br2). An jedem Kohlenstoff, an dem die Spaltung stattfindet (Aufbrechen der Sigma- oder Pi-Bindung, wie oben gesehen), befindet sich die Bindung eines Atoms von Halogen bezieht sich auf die Anzahl der unterbrochenen Verbindungen.
Wenn wir also die Halogenierung (mit Chlorgas) von Cyclopropen durchführen, wird die pi-Bindung zwischen den Kohlenstoffen 1 und 2 gebrochen. An jeden dieser Kohlenstoffe bindet dann ein Chloratom:

Gleichung für die Halogenierung in Cyclopropen
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Additionsreaktion mit Halogenid
Ein Halogenid ist eine anorganische Wasserstoffsäure, die aus einem Wasserstoffatom und einem Wasserstoffatom gebildet wird. Halogen, wie Salzsäure (HCl), Flusssäure (HF), Bromwasserstoffsäure (HBr), Säure Iodwasserstoff (HI).
Beim Additionsreaktion mit Halogenid ist neben der organischen Verbindung das andere Reagens ein Halogenid, also einer der Kohlenstoffe, wobei die Spaltung (Aufbrechen der Sigma- oder Pi-Bindung, wie oben zu sehen), muss das Wasserstoffatom erhalten, und der andere erhält das Halogenid.
Laut der Markownikows Regel, muss das am stärksten hydrierte Kohlenstoffatom (oder der an ein kleineres Radikal gebundene Kohlenstoff) die Wasserstoff, und der weniger hydrierte Kohlenstoff (oder der Kohlenstoff, der an ein größeres Radikal gebunden ist) muss die Halogenid.
Wenn wir diese Reaktion beispielsweise an Propen mit Salzsäure (HCl) durchführen, wird die pi-Bindung zwischen den Kohlenstoffen 1 und 2 gebrochen. Dann bindet Wasserstoff an Kohlenstoff 1 (mehr hydriert) und Chlor an Kohlenstoff 2 (weniger hydriert):
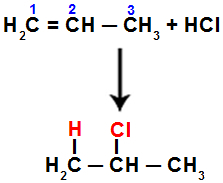
Gleichung für die Addition mit Halogenid in Propen
Hydratationsreaktion
Das Wassermolekül produziert bei der Ionisierung das Hydronium-Kation (H+) und das Hydroxid-Anion (OH-). Aus diesem Grund in diesem Additionsreaktion, neben der organischen Verbindung ist der andere Reaktant Wasser. Somit erhält einer der Kohlenstoffe, an denen die Spaltung stattfindet (Aufbrechen der Sigma- oder Pi-Bindung, wie oben gesehen), das Hydronium-Kation und der andere das Hydroxid-Anion.
Nach der Markownikow-Regel ist das am stärksten hydrierte Kohlenstoffatom (oder der an ein kleineres Radikal gebundene Kohlenstoff) muss das Hydronium erhalten, und der weniger hydrierte Kohlenstoff (oder der Kohlenstoff, der an ein größeres Radikal gebunden ist) muss die Hydroxid.
Wenn wir beispielsweise Penta-1,4-Dien hydratisieren, wird die pi-Bindung zwischen den Kohlenstoffen 1 und 2 und zwischen den Kohlenstoffen 4 und 5 gebrochen. Dann erhalten die Kohlenstoffe 1 und 5 das Hydronium und die Kohlenstoffe 2 und 4 das Hydroxid:
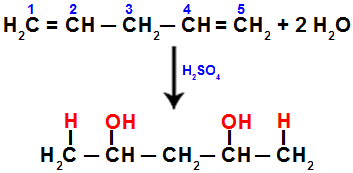
Gleichung für Addition mit Hydratation in Penta-1.4-Dien die
Von mir. Diogo Lopes Dias