DAS Hydrolysekonstante (Kh) bezieht sich auf a chemisches Gleichgewicht entsteht aus der Hydrolyse eines Salzes (chemische Reaktion mit einem löslichen Salz und Wasser).
Als Konstante jedes anderen Gleichgewichts ist der Ausdruck von Hydrolysekonstante wird aus dem Produkt der Produktkonzentrationen dividiert durch das Produkt der Reagenzienkonzentrationen wie folgt berechnet:
Kh = [Produkte]
[Reagenzien]
Die Arbeit mit der Hydrolysekonstante erfordert die Kenntnis von drei wichtigen Phänomenen:
- Dissoziation von Salzen;
- Wasserionisierung;
- Salzhydrolyse.
Dissoziation von Salzen
Wenn ein lösliches Salz zu Wasser hinzugefügt wird, dissoziiert es und setzt ein anderes Kation als Hydronium (H+) und ein anderes Anion als Hydroxyl (OH-) frei.

Um Sie daran zu erinnern, wann ein Salz in Wasser löslich ist oder nicht, Klicke hier und studieren Sie die Salzlöslichkeitstabelle.
Wasserionisation
Wasser ist eine Substanz, die auf natürliche Weise das Phänomen der Selbstionisierung durchläuft, dh ein Hydroniumkation und ein Hydroxylanion produziert.
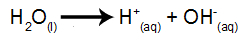
Wasserionisationsgleichung
Hydrolyse eines Salzes
Als lösliches Salz gibt es Ionen an das Wasser ab und das Wasser wird ionisiert, wodurch Ionen in der Mitte kann die Reaktion (Hydrolyse) zwischen den Salzionen und den Wasserionen stattfinden. Wenn diese Reaktion auftritt, sind die möglichen Wechselwirkungen:
- Kation des Salzes mit dem Anion von Wasser (Basenbildung);
- Anion von Salz mit dem Kation von Wasser (Salzbildung);
Die obigen Wechselwirkungen treten nur auf, wenn die gebildete Base oder Säure schwach ist.
Sehen Sie ein Beispiel für die Hydrolyse eines Salzes:
→ Hydrolyse von Ammoniumhypochlorit (NH4ClO)
Wenn Ammoniumhypochlorit zu Wasser hinzugefügt wird, löst es sich auf und dissoziiert, wobei die Ammoniumkationionen (NH4+) und das Hypochloritanion (ClO-) freigesetzt werden:

Gleichung, die die bei der Dissoziation von Ammoniumhypochlorit freigesetzten Ionen zeigt
Da Wasser bei der Ionisierung H+ und OH- produziert, haben wir in der Lösung zwei Kationen und zwei Anionen, die reagieren können. Das NH4+-Kation reagiert nur mit dem OH--Anion, weil es eine schwache Base (NH4OH) bildet. Das ClO--Anion reagiert nur mit dem H+-Kation, weil es eine schwache Säure (HClO) bildet.

Gleichgewichtsgleichung der Ammoniumhypochlorit-Hydrolyse
Konstruktion des Ausdrucks der Hydrolysekonstante
Die Konstruktion der Hydrolysekonstante eines Salzes hängt ausschließlich von der Hydrolysegleichung für dieses Salz ab. Die im vorherigen Punkt bearbeitete Hydrolyse von Ammoniumhypochlorit beispielsweise ergab folgende Gleichung:

Gleichgewichtsgleichung der Ammoniumhypochlorit-Hydrolyse
Wie baut man den Ausdruck von auf? Hydrolysekonstante Produkte und Reagenzien berücksichtigt, wäre der Ausdruck der Konstanten:
Kh = [HClO].[NH4OH]
[ClO-].[NH4+]
HINWEIS: Wasser nimmt an der Gleichung nicht teil, da es ein flüssiges Reagens ist und auch das grundlegende Mittel für das Auftreten von Hydrolyse ist, dh es ist konstant.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
