DAS Bildungsenthalpie, auch genannt Standardbildungsenthalpie, oder Standardbildungswärme, ist die Berechnung der bei der Bildung von 1 Mol eines Stoffes aus einfachen Stoffen freigesetzten oder aufgenommenen Wärme im Normzustand.
Es ist unmöglich, den absoluten Wert der Enthalpien jedes Stoffes zu berechnen, aber es ist möglich, die Variation der Enthalpie, die bei der Reaktion auftritt, mit einem Kalorimeter zu berechnen.
Das muss man sich merken es wurde vereinbart, für einfache Stoffe im Normzustand den Enthalpiewert gleich Null anzunehmen. Wenn wir also die Bildungsenthalpie eines Stoffes herausfinden wollen, brauchen wir nur den Wert der Enthalpie seiner Bildungsreaktion aus einfachen Stoffen zu kennen.
Wir wollen zum Beispiel die Enthalpie von 18 Gramm Wasser ermitteln, was 1 Mol entspricht, da seine Molmasse 18 g/mol beträgt. Dazu benötigen wir zunächst die Reaktion zur Bildung von Wasser aus einfachen Stoffen, wie unten gezeigt:
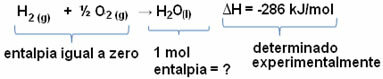
Beachten Sie, dass der Wert der Enthalpieänderung, die bei dieser Reaktion auftrat, experimentell mit einem Kalorimeter bestimmt wurde und -286 kJ/mol beträgt.
Die Formel zur Berechnung dieser Enthalpieänderung (ΔH) lautet:
H = HProdukte - HReagenzien
Da wir also den Wert von ΔH bereits kennen und die Enthalpie der Reaktanten gleich Null ist (da es sich um einfache Stoffe im Standardzustand handelt), können wir daraus schließen dass der Enthalpiewert von 1 mol Wasser gleich der Enthalpieänderung der Bildungsreaktion ist, da es das einzige Produkt dieser Reaktion ist, wie gezeigt unten:
H = HProdukte - HReagenzien
-286 kJ/mol = HH2O - (HH2 + H1/2 Ö2)
-286 kJ/mol = HH2O - 0
HH2O = - 286 kJ/mol
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Diese Art von Enthalpie, die aus der Enthalpie einfacher Stoffe im Normalzustand gewonnen wird, ist daher die Standardbildungsenthalpie (ΔH0).
Nun gibt es viele Stoffe, die nicht direkt durch eine einzige Reaktion gebildet werden, wie zum Beispiel Wasser. In solchen Fällen kann die Bildungsenthalpie aus der Enthalpieänderung der Reaktion berechnet werden.
Zum Beispiel NH4Cl entsteht durch folgende Reaktion:
NH3 + HCl → NH4Cl ΔH = -176 kJ/mol
Beachten Sie, dass keiner der Reaktanten eine einfache Substanz ist, daher können wir ihnen keine Enthalpie von Null zuordnen. Wir müssen die Bildungsenthalpien jedes der Reagenzien kennen, da diese durch Reaktionen zwischen einfachen Substanzen gebildet werden:
NH3: ΔH = -46 kJ/mol
HCl: ΔH = -92,4 kJ/mol
Addiert man diese beiden Enthalpien zusammen, erhält man den Wert der Enthalpie der Reaktanten und kann die Enthalpie von NH. ermitteln4Kl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Einsetzen in die Formel:
H = HProdukte - HReagenzien
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
In diesem Fall haben wir die Werte der Bildungsenthalpien der Reaktanten direkt summiert, da das Reaktionsverhältnis nur 1 mol betrug. Wenn jedoch bei anderen Reaktionen die Molmenge unterschiedlich ist, ist es erforderlich, zunächst die Bildungsenthalpie des Reaktanten mit der Molzahl zu multiplizieren.
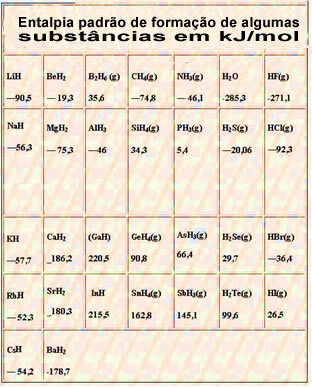
Nachfolgend eine Tabelle mit der Standardbildungsenthalpie einiger Stoffe bei 25 °C und 1 atm:
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Enthalpie der Bildung"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Zugriff am 27. Juni 2021.