Amine sind organische Verbindungen, die durch den Ersatz eines oder mehrerer Wasserstoffatome aus Ammoniak (NH3) durch organische Gruppen. Wenn wir diese Radikale durch R symbolisieren, haben wir, dass ihre funktionelle Gruppe auf die folgenden drei Arten identifiziert werden kann:
R ─ NH2 oder R ─ NH ─ R’ oder R─N─R’
│
R"
Die zu dieser organischen Funktion gehörenden Verbindungen sind in unserem täglichen Leben und in unserem eigenen Organismus sehr wichtig, erfüllen sehr wichtige biologische Funktionen, da sie in Aminosäuren vorkommen, die die grundlegenden Proteine für Lebewesen.
Auch industriell finden sie breite Anwendung, etwa bei der Vulkanisation von Kautschuk, bei der Herstellung von Seifen, Medikamenten und in unzähligen organischen Synthesen. Viele werden leider als Drogen verwendet.
Daher sind viele Amine oft unter gebräuchlichen Namen bekannt. Sehen Sie einige Beispiele:
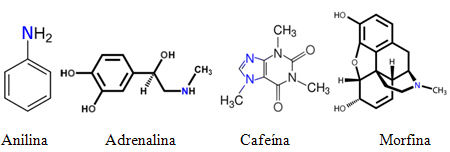
Es ist jedoch nicht möglich, alle bekannten Amine nur mit gebräuchlichen Namen zu benennen, die den genannten ähnlich sind. Benennungsregeln werden benötigt, damit jeder auf der Welt Experimente durchführen kann mit der gleichen Substanz, dass seine Struktur leicht an seinem Namen zu erkennen ist und und umgekehrt.
So hat die IUPAC festgelegt, dass die Nomenklatur von Aminen die folgende Regel erfüllen muss:
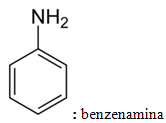
Diese Regel gilt nur für primäre Amine, d. h. in der nur ein Ammoniak-Wasserstoffatom durch einen Rest mit der folgenden funktionellen Gruppe ersetzt wurde: R ─ NH2.
Beispiele:
H3C NH2: Methanamin
H3C CH2 NH2: Ethanamin
H3C CH2 CH2 CH2 NH2: Butan-1-amin
Wenn die Kette verzweigt oder ungesättigt ist, muss die Kette beginnend am nächsten Ende der NH-Gruppe nummeriert werden2 und zeigen Sie, in welchem Kohlenstoff es vorkommt:
NH2
│
H3C ─ CH ─ CH2 CH2 CH2 CH3: Hexan-2-Amin
NH2
│
H3C CH2 CH2 C ═ CH ─ CH3: Hex-2-en-3-Amin
CH3 NH2
│ │
H3C CH CH ─ CH2 CH3: 2-Methyl-pentan-3-amin
CH3 NH2
│ │
H3C ─ CH ─ CH2 ─ CH─CH3: 4-Methyl-pentan-2-amin
Im Falle von sekundäre und tertiäre Amine (bei denen zwei bzw. drei Wasserstoffe der Ammoniakgruppe substituiert sind), die Regel ist anders:

Dem Namen dieser Amine ist der Buchstabe N vorangestellt, um anzuzeigen, dass der Substituent an ein Stickstoffatom gebunden ist und die Substituenten in der Kohlenstoffkette normalerweise durch Zahlen angegeben werden.
Beispiele:
H3C CH2 CH2 NH ─ CH2: N-Methylpropanamin
CH3 CH3
│ │
H3C ─ CH ─ CH2 ─ NEIN ─ CH2 CH3: N-Ethyl-2,N-dimethyl-propanamin
H3C─N─CH2 CH3: N-Dimethylethanamin
│
CH3
H3C─N─CH2 CH3: N-Methyl-ethan-1-amin
│
H
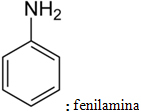
Es gibt zwei Arten von übliche Nomenklatur für Amine. Der erste folgt folgendem Schema:

Beispiele:
H3C NH2: Methylamin
H3C CH2 NH2: Ethylamin
H3C CH2 CH2 CH2 NH2: Butylamin
H3C─N─CH2 CH3: Ethyl-Dimethylamin
│
CH3
H3C─N─CH2 CH3: Ethylmethylamin
│
H
H3C─N─CH3: Trimethylamin
│
CH3
Trimethylamin ist der Hauptbestandteil des üblen Geruchs von faulen Fischen.
Das andere übliche Nomenklatur betrachte die NH-Gruppe2 als Zweig der Kohlenstoffkette und wird durch das Präfix “amino”. Die längste Kette ist die Hauptkette und der Rest ist der Zweig. Siehe die Beispiele:
CH3 CH3
│ │
H3Ç1 C2 C3H C4H2 C5H3: 2-Amino-2,3-dimethyl-pentan
│
NH2
CH2 CH2 CH2 CH2 : 1,4-Diamino-butan
│ │
NH2 NH2
CH2 CH2 CH2 CH2 CH2 : 1,5-Diaminopentan
│ │
NH2 NH2
Diese letzten beiden Verbindungen sind im Alltag jeweils als Putrescin und Cadaverin bekannt, Amine, die bei der Zersetzung menschlicher Leichen entstehen.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/nomenclatura-das-aminas.htm
