Im Text "Titel oder Massenprozentsatz“ haben wir gesehen, wie man das Verhältnis zwischen der Masse des gelösten Stoffes und der Masse der Lösung für feste, flüssige und gasförmige Lösungen berechnet. In diesem Text werden wir jedoch sehen, dass es für Lösungen mit flüssigen oder gasförmigen Bestandteilen auch möglich ist, den Titer über das Volumen zu berechnen.

Der Titel in Band kann durch den Ausdruck berechnet werden:
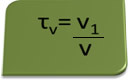
Betrachten Sie als Beispiel eine wässrige Lösung von Ethylalkohol, die als Antiseptikum und Desinfektionsmittel verwendet wird, die hergestellt durch Zugabe von 70 ml reinem Alkohol zu ausreichend Wasser, um ein Volumen von 100 ml zu ergeben Lösung. Also haben wir:
τ = 70 ml = 0,7
100ml
Wir können den Titel auch in Prozent ausdrücken, indem wir das Ergebnis einfach mit 100% multiplizieren. In diesem Fall haben wir also eine 70%ige Ethylalkohollösung, was bedeutet, dass von 100 Volumeneinheiten der Lösung 70 Volumeneinheiten Alkohol sind.
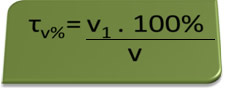
Im folgenden Fall haben wir eine 70 %ige Ethylalkohollösung in einem 250 ml Lösungsvolumen; was bedeutet, dass 175 ml Alkohol sind, nach den Berechnungen:
100 ml 70 ml Alkohol
250 ml x
x = 70. 250
100
X = 175 ml Alkohol

Wir können jedoch nicht sagen, dass wir in diesem Fall 75 ml (250-175) Wasser haben. Im Gegensatz zum Massentiter, bei dem wir die Masse des Lösungsmittels zur Masse des gelösten Stoffes addieren können, um die Masse der Lösung zu ermitteln, kann dies nicht in Relation zum Volumentiter erfolgen.

Dies bedeutet, dass das Lösungsvolumen nicht gleich der Summe aus Lösungsmittelvolumen und Volumen des gelösten Stoffes ist (obwohl der Unterschied oft als vernachlässigbar angesehen werden kann). Dies liegt daran, dass die in diesen Flüssigkeiten vorhandenen intermolekularen Kräfte das Endvolumen beeinflussen.
Im Fall der oben erwähnten Lösung von Ethylalkohol, zum Beispiel, wenn wir Alkohol mit Wasser mischen, kommt es zu einer Kontraktion des Gesamtvolumens der Lösung; Das heißt, das Endvolumen wird kleiner sein, als wenn wir nur das Volumen von Alkohol und Wasser hinzufügen. Dies liegt daran, dass die Alkoholmoleküle Bindungen oder Wasserstoffbrücken mit den Wassermolekülen eingehen, wodurch die Abstände zwischen ihnen verringert werden.
Daher muss in diesem und anderen Fällen das Volumen der Lösung experimentell gemessen werden, wenn es in der Übung nicht bereitgestellt wird.
Der Volumenprozentsatz wird, wie oben erwähnt, häufig bei alkoholischen Getränken und handelsüblichem Alkohol verwendet. Siehe zwei wichtige Anwendungen dieser Berechnung:
- Alkoholtester: Der Alkoholtester misst die Konzentration von Ethylalkohol im Blut, und in Brasilien ist es verboten, Fahrzeuge aller Art mit einem Blutalkoholgehalt von mindestens 0,1 Vol.-% zu fahren. Eine Person mit diesem Alkoholgehalt hat pro Liter Blut 1 ml Alkohol, wie die folgenden Berechnungen zeigen:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 l = 1 ml
100%

- Ethanolgehalt in Benzin: in Brasilien wird Benzin durch den Zusatz von Ethanol reguliert. Der Ethanolgehalt im Benzin darf jedoch höchstens 24 Vol.-% an wasserfreiem Alkohol betragen (da Benzin wasserfrei sein muss). Je mehr Ethanol dem Benzin beigemischt wird, desto heller wird die Farbe des Kraftstoffs und seine Dichte nimmt zu.
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm
